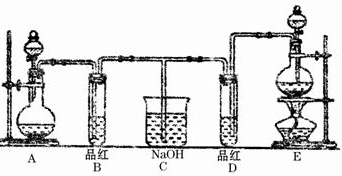
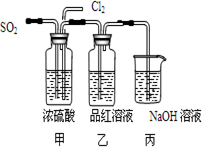
摘要:21. 某化学实验小组的同学为了探究和比较SO2和Cl2水的漂白性.设计了如下的实验装置. (1)实验室用装置A制备SO2气体.写出A中发生反应的化学方程式: .某同学在实验时发现打开A中的分液漏斗活塞后.漏斗中液体没流下.你想原因可能是: (2)实验室用装置E制备Cl2气体.写出E中发生反应的离子方程式: .指出该反应中的液体反应物在反应中所表现出的性质: . (3)①反应开始后一段时间后.观察到B.D两个试管中的品红溶液出现的现象是: : I.都褪色 II.都不褪色 Ⅲ.B褪色.D不褪色 Ⅳ.B不褪色.D褪色 ②停止通气后.再给B.D两个试管加热.两个试管中的现象分别为B: .D: . (4)第二个实验小组的同学认为SO2和Cl2水都有漂白性.二者混合后的漂白性会更强.他们将制得的SO2和Cl2同时通入到品红溶液中.结果褪色效果并不像想象的那样快.为了探讨SO2和Cl2按1:1通入的漂白效果.他们设计了如下实验装置: ①实验开始后.乙装置中出现的现象: ②用离子方程式表示乙中产生该现象的原因:
网址:http://m.1010jiajiao.com/timu3_id_398789[举报]
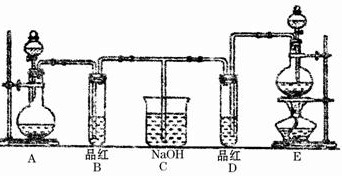
某化学实验小组的同学为了探究和比较SO2和Cl2水的漂白性,设计了如下的实验装置.
(1)检查E装置气密性的方法是
(2)实验室用装置E制备Cl2气体,写出E中发生反应的离子方程式:
(3)反应开始后一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
①都褪色 ②都不褪色 ③B褪色,D不褪色 ④B不褪色,D褪色
停止通气后,再给B、D两个试管加热,两个试管中的现象分别为B:
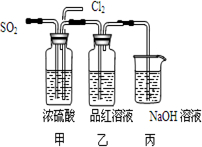
(4)第二个实验小组的同学认为SO2和Cl2水都有漂白性,二者混合后的漂白性会更强,他们将制得的SO2和Cl2同时通入到品红溶液中,结果褪色效果并不像想象的那样快.为了探讨SO2和Cl2按1:1通入的漂白效果,他们设计了如下图实验装置:
①实验开始后,乙装置中出现的现象:
②用离子方程式表示乙中产生该现象的原因:
查看习题详情和答案>>
(1)检查E装置气密性的方法是
在D中装水浸没导管一段距离,关闭分液漏斗活塞,用酒精灯加热烧瓶,看到D中有气泡冒出,停止加热有液柱回流,则说明气密性良好
在D中装水浸没导管一段距离,关闭分液漏斗活塞,用酒精灯加热烧瓶,看到D中有气泡冒出,停止加热有液柱回流,则说明气密性良好
(2)实验室用装置E制备Cl2气体,写出E中发生反应的离子方程式:
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
| ||
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
.
| ||
(3)反应开始后一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
①
①
:(填写序号)①都褪色 ②都不褪色 ③B褪色,D不褪色 ④B不褪色,D褪色
停止通气后,再给B、D两个试管加热,两个试管中的现象分别为B:
由无色变为红色
由无色变为红色
,D:无明显现象
无明显现象
.(4)第二个实验小组的同学认为SO2和Cl2水都有漂白性,二者混合后的漂白性会更强,他们将制得的SO2和Cl2同时通入到品红溶液中,结果褪色效果并不像想象的那样快.为了探讨SO2和Cl2按1:1通入的漂白效果,他们设计了如下图实验装置:
①实验开始后,乙装置中出现的现象:
品红未褪色
品红未褪色
②用离子方程式表示乙中产生该现象的原因:
SO2+Cl2+2H2O=4H++SO42-+2Cl-
SO2+Cl2+2H2O=4H++SO42-+2Cl-


某化学实验小组的同学为了探究和比较SO2和Cl2水的漂白性,设计了如图的实验装置.
(1)实验室用装置A制备SO2气体,写出A中发生反应的化学方程式: .某同学在实验时发现打开A中的分液漏斗活塞后,漏斗中液体没流下,你想原因可能是: .
(2)实验室用装置E制备Cl2气体,写出E中发生反应的离子方程式: ,指出该反应中的液体反应物在反应中所表现出的性质: .
(3)①反应开始后一段时间后,观察到B、D两个试管中的品红溶液出现的现象是: :(填写序号字母).
I.都褪色 II.都不褪色Ⅲ.B褪色,D不褪色Ⅳ.B不褪色,D褪色
②停止通气后,再给B、D两个试管加热,两个试管中的现象分别为B: ,D: .
(4)第二个实验小组的同学认为SO2和Cl2水都有漂白性,二者混合后的漂白性会更强,他们将制得的SO2和Cl2同时通入到品红溶液中,结果褪色效果并不像想象的那样快.为了探讨SO2和Cl2按1:1通入的漂白效果,他们设计了如下实验装置:

①实验开始后,乙装置中出现的现象: .
②用离子方程式表示乙中产生该现象的原因: .
查看习题详情和答案>>

(1)实验室用装置A制备SO2气体,写出A中发生反应的化学方程式:
(2)实验室用装置E制备Cl2气体,写出E中发生反应的离子方程式:
(3)①反应开始后一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
I.都褪色 II.都不褪色Ⅲ.B褪色,D不褪色Ⅳ.B不褪色,D褪色
②停止通气后,再给B、D两个试管加热,两个试管中的现象分别为B:
(4)第二个实验小组的同学认为SO2和Cl2水都有漂白性,二者混合后的漂白性会更强,他们将制得的SO2和Cl2同时通入到品红溶液中,结果褪色效果并不像想象的那样快.为了探讨SO2和Cl2按1:1通入的漂白效果,他们设计了如下实验装置:

①实验开始后,乙装置中出现的现象:
②用离子方程式表示乙中产生该现象的原因:
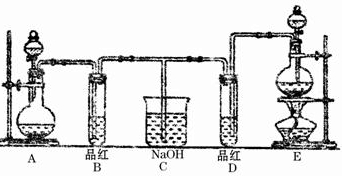
某化学实验小组的同学为了探究和比较SO2和Cl2水的漂白性,设计了如下的实验装置.
(1)检查E装置气密性的方法是______
(2)实验室用装置E制备Cl2气体,写出E中发生反应的离子方程式:______.
(3)反应开始后一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:______:(填写序号)
①都褪色 ②都不褪色 ③B褪色,D不褪色 ④B不褪色,D褪色
停止通气后,再给B、D两个试管加热,两个试管中的现象分别为B:______,D:______.
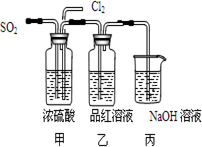
(4)第二个实验小组的同学认为SO2和Cl2水都有漂白性,二者混合后的漂白性会更强,他们将制得的SO2和Cl2同时通入到品红溶液中,结果褪色效果并不像想象的那样快.为了探讨SO2和Cl2按1:1通入的漂白效果,他们设计了如下图实验装置:
①实验开始后,乙装置中出现的现象:______
②用离子方程式表示乙中产生该现象的原因:______
查看习题详情和答案>>
某化学实验小组的同学为了探究和比较SO2和Cl2水的漂白性,设计了如下的实验装置.
(1)检查E装置气密性的方法是______
(2)实验室用装置E制备Cl2气体,写出E中发生反应的离子方程式:______.
(3)反应开始后一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:______:(填写序号)
①都褪色 ②都不褪色 ③B褪色,D不褪色 ④B不褪色,D褪色
停止通气后,再给B、D两个试管加热,两个试管中的现象分别为B:______,D:______.
(4)第二个实验小组的同学认为SO2和Cl2水都有漂白性,二者混合后的漂白性会更强,他们将制得的SO2和Cl2同时通入到品红溶液中,结果褪色效果并不像想象的那样快.为了探讨SO2和Cl2按1:1通入的漂白效果,他们设计了如下图实验装置:
①实验开始后,乙装置中出现的现象:______
②用离子方程式表示乙中产生该现象的原因:______
查看习题详情和答案>>
(1)检查E装置气密性的方法是______
(2)实验室用装置E制备Cl2气体,写出E中发生反应的离子方程式:______.
(3)反应开始后一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:______:(填写序号)
①都褪色 ②都不褪色 ③B褪色,D不褪色 ④B不褪色,D褪色
停止通气后,再给B、D两个试管加热,两个试管中的现象分别为B:______,D:______.
(4)第二个实验小组的同学认为SO2和Cl2水都有漂白性,二者混合后的漂白性会更强,他们将制得的SO2和Cl2同时通入到品红溶液中,结果褪色效果并不像想象的那样快.为了探讨SO2和Cl2按1:1通入的漂白效果,他们设计了如下图实验装置:
①实验开始后,乙装置中出现的现象:______
②用离子方程式表示乙中产生该现象的原因:______


(14分)某化学实验小组的同学为了探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
 |
(1)实验室用装置A制备SO2 。某同学在实验时发现打开A中的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是: 。
(2)实验室用装置E制备Cl2 ,其反应的化学方程式为:MnO2+4HCl(浓)=== MnCl2 + Cl2↑+2H2O请指出该反应中的液体反应物在反应中所表现出的化学性质: 。(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B: ,D: 。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B: ,D: 。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按1 : 1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示) 。
查看习题详情和答案>>