网址:http://m.1010jiajiao.com/timu3_id_3987362[举报]
(1)该溶液与Al2O3反应后有Al3+生成,一定不会含有大量的________
(2)该溶液与Al2O3反应后有AlO2- 生成,可能含有大量的____________
Ⅱ.研究性学习小组的同学为了了解Cu及其化合物的性质,提出以下问题;
①Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②Fe的+2价化合物的稳定性比+3价化合物的稳定性小,Cu的+l价化合物的稳定性也比+2价化合物的稳定性小吗?
(1)解决问题①需要用到的药品有CuSO4溶液、___________ (填字母)。
A.AlCl3溶液 B.NaOH溶液 C.稀H2SO4 D.H2O2溶液
假若Cu(OH)2具有两性,应该看到的实验现象是____________
(2)为了比较Cu的+1价化合物和+2价化合物的稳定性,他们取98gCu(OH)2固体,加热至800℃~1000℃时,得到黑色固体粉末,继续加热到1 000℃以上,黑色粉末全部变成红色粉末X。冷却后称量,X的质量为72g。向X中加入过量稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在。据此可推得,X的化学式为__________可以得出的结论是_______________。
I某无色溶液只含有下列8种离子中的某几种:Na+、H+、Mg2+、Ag+、Cr、OH-、HCO![]() 、NO
、NO![]() 。已知该溶液可与Al2O3反应,则:
。已知该溶液可与Al2O3反应,则:
(1)该溶液与Al2O3反应后有Al3+生成,则原溶液中一定含有 ,
一定不会含有大量的 。
(2)该溶液与Al2O3反应后有【Al(OH)4】生成,则原溶液中一定含有 ,可能含有
大量的 。
(3)写出该溶液与Al2O3反应生成【Al(OH)4】的离子方程式 。
Ⅱ. 研究性学习小组的同学为了了解Cu及其化合物的性质,提出以下问题;
①Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②Fe的+2价化合物的稳定性比+3价化合物的稳定性小,Cu的+l价化合物的稳定性也比+2价化合物的稳定性小吗?
③CuO能被H2、CO等还原,也能被NH3还原吗?
(1)解决问题①需要用到的药品有CuSO4溶液、 (填字母)。
A.AlCl3溶液 B.NaOH溶液 C.稀H2SO4 D.H2O2溶液
假若Cu(OH)2具有两性,应该看到的实验现象是
。
(2)为了比较Cu的+1价化合物和+2价化合物的稳定性,他们取98gCu(OH)2固体,加热至800℃~1000℃时,得到黑色固体粉末,继续加热到1 000℃以上,黑色粉末全部变成红色粉末X。冷却后称量,X的质量为72g。向X中加入过量稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在。据此可推得,X的化学式为 ,可以得出的结论是
。
(3)为解决问题③,设计了如下的实验装置(夹持及尾气处理装置未画出):
在实验中观察到CuO变成红色物质,无水CuSO4变成蓝色,生成物中还有一种无污染的单质气体。装置A的作用是 ,B中发生反应的化学方
程式为 。

已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生。
①向其中滴加双氧水,发生反应:H2O2+2H++2Iˉ =2H2O+I2;
②生成的I2立即与试剂X反应,当试剂X消耗完后,生成的 I2 才会遇淀粉变蓝因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算:H2O2+2H++2Iˉ = 2H2O+I2的反应速率。
下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
|
编号 |
往烧杯中加入的试剂及其用量(mL) |
催化剂 |
开始变蓝时间(min) |
||||
|
0.1 mol·Lˉ1 KI溶液 |
H2O |
0.01 mol·Lˉ1 X 溶液 |
0.1mol·Lˉ1 双氧水 |
1 mol·L1 稀盐酸 |
|||
|
1 |
20.0 |
10.0 |
10.0 |
20.0 |
20.0 |
无 |
1.4 |
|
2 |
20.0 |
m |
10.0 |
10.0 |
n |
无 |
2.8 |
|
3 |
10.0 |
20.0 |
10.0 |
20.0 |
20.0 |
无 |
2.8 |
|
4 |
20.0 |
10.0 |
10.0 |
20.0 |
20.0 |
5滴Fe2(SO4)3 |
0.6 |
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2Iˉ = 2H2O+I2反应速率的影响。实验2中m= ,n= 。
(2)已知,I2与X完全反应时,两者物质的量之比为1∶2。按表格中的X和KI的加入量,加入V(H2O2)>________,才确保看到蓝色。
(3)实验1,浓度c(X)~ t的变化曲线如图,若保持其它条件不变,请在答题卡坐标图中,分别画出实验3、实验4,c(X) ~ t的变化曲线图(进行相应的标注)。

(4)实验4表明:硫酸铁能提高反应速率。催化剂能加快反应速率是因为催化剂 (填“提高”或“降低”)了反应活化能。
(5)环境友好型铝—碘电池已研制成功,已知电池总反应为:2Al(s)+3I2(s) 2AlI3(s)。含Iˉ传导有机晶体合成物作为电解质,该电池负极的电极反应为:________________________,充电时Al连接电源的___________极。
2AlI3(s)。含Iˉ传导有机晶体合成物作为电解质,该电池负极的电极反应为:________________________,充电时Al连接电源的___________极。
(6)已知:N2H4(l) +2H2O2(l)= N2(g)+4H2O(g) △H1= -640kJ/mol
H2O(l)=H2O(g) △H2=+44.0kJ/mol
则0.25mol 液态肼与液态双氧水反应生成液态水时放出的热量是 。
查看习题详情和答案>>
已知:将KI、盐酸、试剂X和淀粉四种溶液混合,无反应发生。
①向其中滴加双氧水,发生反应:H2O2+2H++2Iˉ=2H2O+I2;
②生成的I2立即与试剂X反应,当试剂X消耗完后,生成的 I2才会遇淀粉变蓝因此,根据试剂X的量、滴入双氧水至溶液变蓝所需的时间,即可推算:H2O2+2H++2Iˉ= 2H2O+I2的反应速率。
下表为某同学依据上述原理设计的实验及实验记录(各实验均在室温条件下进行):
| 编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 开始变蓝时间(min) | ||||
| 0.1 mol·Lˉ1 KI溶液 | H2O | 0.01 mol·Lˉ1 X溶液 | 0.1mol·Lˉ1 双氧水 | 1 mol·L1 稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
(1)已知:实验1、2的目的是探究H2O2浓度对H2O2+2H++2Iˉ= 2H2O+I2反应速率的影响。实验2中m= ,n= 。
(2)已知,I2与X完全反应时,两者物质的量之比为1∶2。按表格中的X和KI的加入量,加入V(H2O2)>________,才确保看到蓝色。
(3)实验1,浓度c(X)~ t的变化曲线如图,若保持其它条件不变,请在答题卡坐标图中,分别画出实验3、实验4,c(X) ~ t的变化曲线图(进行相应的标注)。

(4)实验4表明:硫酸铁能提高反应速率。催化剂能加快反应速率是因为催化剂 (填“提高”或“降低”)了反应活化能。
(5)环境友好型铝—碘电池已研制成功,已知电池总反应为:2Al(s)+3I2(s)
 2AlI3(s)。含Iˉ传导有机晶体合成物作为电解质,该电池负极的电极反应为:________________________,充电时Al连接电源的___________极。
2AlI3(s)。含Iˉ传导有机晶体合成物作为电解质,该电池负极的电极反应为:________________________,充电时Al连接电源的___________极。(6)已知:N2H4(l) +2H2O2(l)= N2(g)+4H2O(g) △H1= -640kJ/mol
H2O(l)=H2O(g) △H2=+44.0kJ/mol
则0.25mol 液态肼与液态双氧水反应生成液态水时放出的热量是 。 查看习题详情和答案>>
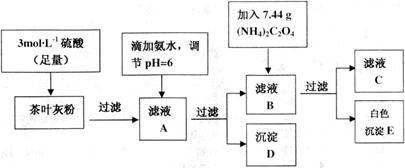
茶叶中含有多种有益于人体健康的有机成分及钙、铁等微量金属元素,某化学研究性学习小组设计方案用以测定某品牌茶叶中钙元素的质量分数并检验铁元素的存在(已知![]() 为白色沉淀物质)。首先取200g茶叶样品焙烧得灰粉后进行如下操作:
为白色沉淀物质)。首先取200g茶叶样品焙烧得灰粉后进行如下操作:
请回答下列有关问题:
(1)文献资料显示,某些金属离子的氢氧化物完全沉淀的pH为::
| 离子 |
|
|
| 完全沉淀时的pH | 13 | 4.1 |
实验前要先将茶叶样品高温灼烧成灰粉,其主要目的是__________。
(2)写出从滤液A→沉淀D的离子反应方程式__________。
(3)为保证实验精确度,沉淀D及E需要分别洗涤,并将洗涤液转移回母液中,试
判断沉淀D已经洗涤干净的方法是__________。
(4)用KMnO![]() 标准溶液滴定C溶液时所发生的反应为:
标准溶液滴定C溶液时所发生的反应为:
![]() 。
。
现将滤液C稀释至500 mL,再取其中的25.00 mL溶液,用硫酸酸化后,用0.1000
mol·L-1的KMnO4标准溶液滴定,终点时消耗KMnO4溶液10.00 mL。
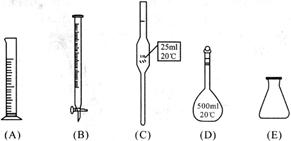
①此步操作过程中需要用到下列哪些仪器(填写序号)________;
②达到滴定终点时,溶液的颜色变化是________;
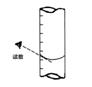
③滴定到终点,静置后,如右图读取KMnO4标准溶液的刻度数据,则测定的钙元素含量将________ (填“偏高”、“偏低”、“无影响”)。
(5)原茶叶中钙元素的质量分数为________。
(6)可以通过检验滤液A来验证该品牌茶叶中是否含有铁元素,所加试剂及实验现象是________。
查看习题详情和答案>>