网址:http://m.1010jiajiao.com/timu3_id_3986205[举报]
工业上利用含锰废水(主要含MnSO4、H2SO4、和铁、铝、铜等金属的硫酸盐)制取碳酸锰(MnCO3)。步骤如下:
Ⅰ.氧化:向废水中加入氧化剂;
Ⅱ.中和:控制温度在40~50 ℃,加入氨水,过滤;
Ⅲ.除重金属:向滤液中加入BaS溶液,除去Cu2+ 等重金属,过滤,得MnSO4溶液;
Ⅳ.制固体MnSO4:从MnSO4溶液得其固体;
Ⅴ.制MnCO3:用水溶解MnSO4固体,加入NH4HCO3溶液,得MnCO3沉淀粗品;
Ⅵ.洗涤:用水洗涤MnCO3粗品至无SO42-,获得高纯MnCO3。
回答下列问题:
(1)Ⅰ中,下列氧化剂均能把Fe2+氧化为Fe3+,最佳的试剂是_____。
a.浓HNO3 b.MnO2 c.K2Cr2O7
(2)Ⅱ中,氨水除中和酸外,同时沉淀Fe3+、Al3+ 等,沉淀Al3+的离子方程式是:
______________________________________________________。
(3)Ⅳ中,溶液需浓缩、结晶、_______(填一种分离操作的名称),得MnSO4固体。
(4)Ⅴ中生成MnCO3沉淀的离子方程式是:
______________________________________________________。
(5)由MnCO3 可制得重要的催化剂MnO2,MnCO3 → MnO2 + CO。
现加热分解 460.0 kg的MnCO3,得到332.0 kg产品,若产品中杂质只有MnO,则该产品中MnO2的质量是 kg。(摩尔质量/g·![]() :MnCO3 115 MnO2 87 MnO 71)
:MnCO3 115 MnO2 87 MnO 71)
(10分)工业上利用含锰废水(主要含MnSO4、H2SO4、和铁、铝、铜等金属的硫酸盐)制取碳酸锰(MnCO3)。步骤如下:
Ⅰ.氧化:向废水中加入氧化剂;
Ⅱ.中和:控制温度在40~50 ℃,加入氨水,过滤;
Ⅲ.除重金属:向滤液中加入BaS溶液,除去Cu2+ 等重金属,过滤,得MnSO4溶液;
Ⅳ.制固体MnSO4:从MnSO4溶液得其固体;
Ⅴ.制MnCO3:用水溶解MnSO4固体,加入NH4HCO3溶液,得MnCO3沉淀粗品;
Ⅵ.洗涤:用水洗涤MnCO3粗品至无SO42-,获得高纯MnCO3。
回答下列问题:
(1)Ⅰ中,下列氧化剂均能把Fe2+氧化为Fe3+,最佳的试剂是_____。
a.浓HNO3 b.MnO2 c.K2Cr2O7
(2)Ⅱ中,氨水除中和酸外,同时沉淀Fe3+、Al3+ 等,沉淀Al3+的离子方程式是:
______________________________________________________。
(3)Ⅳ中,溶液需浓缩、结晶、_______(填一种分离操作的名称),得MnSO4固体。
(4)Ⅴ中生成MnCO3沉淀的离子方程式是:
______________________________________________________。
(5)由MnCO3 可制得重要的催化剂MnO2,MnCO3 → MnO2+ CO。
现加热分解 460.0 kg的MnCO3,得到332.0 kg产品,若产品中杂质只有MnO,则该产品中MnO2的质量是 kg。(摩尔质量/g·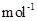 :MnCO3 115 MnO2 87 MnO 71)
:MnCO3 115 MnO2 87 MnO 71)
查看习题详情和答案>>
(10分)工业上利用含锰废水(主要含MnSO4、H2SO4、和铁、铝、铜等金属的硫酸盐)制取碳酸锰(MnCO3)。步骤如下:
Ⅰ.氧化:向废水中加入氧化剂;
Ⅱ.中和:控制温度在40~50 ℃,加入氨水,过滤;
Ⅲ.除重金属:向滤液中加入BaS溶液,除去Cu2+等重金属,过滤,得MnSO4溶液;
Ⅳ.制固体MnSO4:从MnSO4溶液得其固体;
Ⅴ.制MnCO3:用水溶解MnSO4固体,加入NH4HCO3溶液,得MnCO3沉淀粗品;
Ⅵ.洗涤:用水洗涤MnCO3粗品至无SO42-,获得高纯MnCO3。
回答下列问题:
(1)Ⅰ中,下列氧化剂均能把Fe2+氧化为Fe3+,最佳的试剂是_____。
a.浓HNO3 b.MnO2 c.K2Cr2O7
(2)Ⅱ中,氨水除中和酸外,同时沉淀Fe3+、Al3+等,沉淀Al3+的离子方程式是:
______________________________________________________。
(3)Ⅳ中,溶液需浓缩、结晶、_______(填一种分离操作的名称),得MnSO4固体。
(4)Ⅴ中生成MnCO3沉淀的离子方程式是:
______________________________________________________。
(5)由MnCO3可制得重要的催化剂MnO2,MnCO3 → MnO2 + CO。
现加热分解 460.0 kg的MnCO3,得到332.0 kg产品,若产品中杂质只有MnO,则该产品中MnO2的质量是 kg。(摩尔质量/g·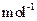 :MnCO3 115 MnO2 87 MnO 71)
:MnCO3 115 MnO2 87 MnO 71)
(10分)工业上利用含锰废水(主要含MnSO4、H2SO4、和铁、铝、铜等金属的硫酸盐)制取碳酸锰(MnCO3)。步骤如下:
Ⅰ.氧化:向废水中加入氧化剂;
Ⅱ.中和:控制温度在40~50 ℃,加入氨水,过滤;
Ⅲ.除重金属:向滤液中加入BaS溶液,除去Cu2+ 等重金属,过滤,得MnSO4溶液;
Ⅳ.制固体MnSO4:从MnSO4溶液得其固体;
Ⅴ.制MnCO3:用水溶解MnSO4固体,加入NH4HCO3溶液,得MnCO3沉淀粗品;
Ⅵ.洗涤:用水洗涤MnCO3粗品至无SO42-,获得高纯MnCO3。
回答下列问题:
(1)Ⅰ中,下列氧化剂均能把Fe2+氧化为Fe3+,最佳的试剂是_____。
a.浓HNO3 b.MnO2 c.K2Cr2O7
(2)Ⅱ中,氨水除中和酸外,同时沉淀Fe3+、Al3+ 等,沉淀Al3+的离子方程式是:
______________________________________________________。
(3)Ⅳ中,溶液需浓缩、结晶、_______(填一种分离操作的名称),得MnSO4固体。
(4)Ⅴ中生成MnCO3沉淀的离子方程式是:
______________________________________________________。
(5)由MnCO3 可制得重要的催化剂MnO2,MnCO3 → MnO2 + CO。
现加热分解 460.0 kg的MnCO3,得到332.0 kg产品,若产品中杂质只有MnO,则该产品中MnO2的质量是
kg。(摩尔质量/g·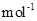 :MnCO3 115
MnO2 87 MnO 71)
:MnCO3 115
MnO2 87 MnO 71)
查看习题详情和答案>>
请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程.
限选试剂:①蒸馏水②3% H2O2溶液③氧化铜④1.0 mol?L-1盐酸 ⑤浓硫酸⑥1.0 mol?L-1 NaOH溶液⑦澄淸石灰水 ⑧0.5mol?L-1CuSO4溶液⑨2%KSCN溶液⑩苯酚溶液
Ⅰ.若用一套连续实验装置检验气体产物中CO的存在,并验证检验过程中有CO2生成,应选用的试剂为(按先后顺序把所选试剂的标号填入空格内)
Ⅱ.探究固体产物中铁元素的存在形式.
(1)提出合理假设
假设1:只有Fe;
假设2:只有FeO;
假设3:
(2)设计实验方案并实验验证:
步骤1:取通量固体产物于试管中,加入足量蒸馏水溶解,过滤分离出不溶固体.
步骤2;取少置上述不溶固体放入试管中,加入足量
步骤3;取步骤2所得暗红色固体于试管中,滴加过量
(3)问题讨论
若固体产物中FeO含量较少,用步骤3方法难以确定.请你设计实验方案证明假设3成立(写出实验的操作步骤、现象与结论):
Ⅲ.拓展与延伸.有资料介绍“在含Fe2+的溶液中,先滴加少量新制饱和氯水,然后滴加KSCN溶液,溶液呈红色;若再滴加过量氯水,却发现红色褪去”.假设溶液中的+3价铁还能被氯水氧化为更高价的FeO42-,试写出该反应的离子方程式