题目内容
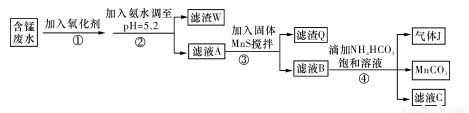
(10分)工业上利用含锰废水(主要含MnSO4、H2SO4、和铁、铝、铜等金属的硫酸盐)制取碳酸锰(MnCO3)。步骤如下:
Ⅰ.氧化:向废水中加入氧化剂;
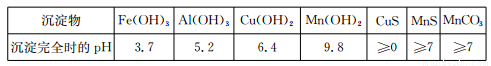
Ⅱ.中和:控制温度在40~50 ℃,加入氨水,过滤;
Ⅲ.除重金属:向滤液中加入BaS溶液,除去Cu2+ 等重金属,过滤,得MnSO4溶液;
Ⅳ.制固体MnSO4:从MnSO4溶液得其固体;
Ⅴ.制MnCO3:用水溶解MnSO4固体,加入NH4HCO3溶液,得MnCO3沉淀粗品;
Ⅵ.洗涤:用水洗涤MnCO3粗品至无SO42-,获得高纯MnCO3。
回答下列问题:
(1)Ⅰ中,下列氧化剂均能把Fe2+氧化为Fe3+,最佳的试剂是_____。
a.浓HNO3 b.MnO2 c.K2Cr2O7
(2)Ⅱ中,氨水除中和酸外,同时沉淀Fe3+、Al3+ 等,沉淀Al3+的离子方程式是:
______________________________________________________。
(3)Ⅳ中,溶液需浓缩、结晶、_______(填一种分离操作的名称),得MnSO4固体。
(4)Ⅴ中生成MnCO3沉淀的离子方程式是:
______________________________________________________。
(5)由MnCO3 可制得重要的催化剂MnO2,MnCO3 → MnO2+ CO。
现加热分解 460.0 kg的MnCO3,得到332.0 kg产品,若产品中杂质只有MnO,则该产品中MnO2的质量是 kg。(摩尔质量/g·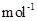 :MnCO3 115 MnO2 87 MnO 71)
:MnCO3 115 MnO2 87 MnO 71)
(10分)(每空2分)
(1) b
(2) Al3++ 3NH3·H2O == Al(OH)3 ↓ + 3NH4+
(3)过滤
(4)Mn2+ + 2HCO3- == MnCO3 ↓ + H2O + CO2↑
(5)261.0?
解析:(1)只能用双氧水来氧化,另外两种物质虽能氧化亚铁离子,但是又引入了新的杂质。
(5)MnCO3 → MnO2 + CO。MnCO3的物质的量为4000mol,如果产物全是MnO2,产物质量应为348.0Kg,因为有杂质MnO,产物质量为332.0Kg,MnO的物质的量为:![]()
![]() 。依据质量守恒,MnO2物质的量为3000mol,质量为261.0Kg。
。依据质量守恒,MnO2物质的量为3000mol,质量为261.0Kg。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案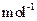 :MnCO3 115 MnO2 87 MnO 71)
:MnCO3 115 MnO2 87 MnO 71)
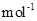 :MnCO3 115
MnO2 87 MnO 71)
:MnCO3 115
MnO2 87 MnO 71)