摘要:16.有五种生物.它们属于同一科同一属.下表表示的是它们在六个显著特征方面的情况(“+ 表示该物种具有该特征.“– 表示该物种不具有该特征). 物种 特征 1 2 3 4 5 6 K + – + + + – L – – – – + – M + – – – – – N – + – – – – E + – + + – – 根据进化理论.物种最可能的进化路径是特征改变数量最少的那一条.如果是这样的话.物种E最可能的祖先是 ( ) A.K B. L C. M D. N
网址:http://m.1010jiajiao.com/timu3_id_3984565[举报]
(2011?延庆县一模)A、B、C、D、E五种短周期元素,原子序数依次增大.A元素的单质是自然界最轻的气体,E单质须保存在煤油中.A与B、C分别构成电子数相等的化合物M、N,且M是一种能产生温室效应的最简单的有机气体物质;D元素最外层电子数是次外层电子数的3倍;
回答下列问题:
(1)N的电子式为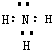
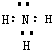 ;M分子中含有
;M分子中含有
(2)D与E以1:1形成的化合物与水反应的化学反应方程式
(3)A、B、C、D可形成阳离子和阴离子个数比是1:1的离子化合物X;A、D、E可形成化合物Y;X与Y以物质的量之比1:2加热反应,写出反应的化学方程式
(4)由N与D的单质、KOH溶液构成原电池,负极会产生C的单质.则其负极反应为
(5)在一定温度下,将4mol C单质和12mol A单质通入到体积为2L的密闭容器中,发生反应,2min达到平衡状态时,A单质的转化率是50%,则用A单质表示该反应的平均速率为
.从化学平衡移动的角度分析,提高A单质的转化率可以采取的措施是
a、及时分离出生成物 b、平衡后再加入6molA物质 c、增大压强 d、使用催化剂 e、平衡后再加入2molC物质.
查看习题详情和答案>>
回答下列问题:
(1)N的电子式为
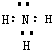
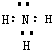
极性
极性
(填“极性”或“非极性”)键(2)D与E以1:1形成的化合物与水反应的化学反应方程式
2Na2O2+2CO2═2Na2CO3+O2↑
2Na2O2+2CO2═2Na2CO3+O2↑
(3)A、B、C、D可形成阳离子和阴离子个数比是1:1的离子化合物X;A、D、E可形成化合物Y;X与Y以物质的量之比1:2加热反应,写出反应的化学方程式
NH4HCO3+2NaOH
Na2CO3+NH3↑+2H2O
| ||
NH4HCO3+2NaOH
Na2CO3+NH3↑+2H2O
.反应后水溶液显
| ||
碱
碱
(填“酸”“碱”或“中”)性,原因是CO32-+H2O HCO3-+OH-
HCO3-+OH-
 HCO3-+OH-
HCO3-+OH-CO32-+H2O HCO3-+OH-
HCO3-+OH-
(用离子方程式表示) HCO3-+OH-
HCO3-+OH-(4)由N与D的单质、KOH溶液构成原电池,负极会产生C的单质.则其负极反应为
2NH3-6e-+6OH-═N2+6H2O
2NH3-6e-+6OH-═N2+6H2O
;一段时间后,溶液pH减小
减小
(填“增大”“减小”或“不变”).(5)在一定温度下,将4mol C单质和12mol A单质通入到体积为2L的密闭容器中,发生反应,2min达到平衡状态时,A单质的转化率是50%,则用A单质表示该反应的平均速率为
0.5mol/L-1min-1
0.5mol/L-1min-1
;该温度下的平衡常数为K=| 4 |
| 27 |
| 4 |
| 27 |
a、c、e
a、c、e
(选填序号字母).a、及时分离出生成物 b、平衡后再加入6molA物质 c、增大压强 d、使用催化剂 e、平衡后再加入2molC物质.
下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
试回答下列问题:
(1)I的元素符号为
(2)写出基态时J元素原子的电子排布式
(3)下列对比正确的是
a.原子半径H>G>B>A; b.第一电离能E>D>C>B;
c.电负性A>H>G>K; d.最高价氧化物的水化物酸性B>A>H>G;
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是
a.L位于元素周期表中第五周期、ⅠA族,属于s区元素;
b.O位于元素周期表中第七周期、ⅧB族,属于d区元素;
c.M的外围电子排布式为6s1,属于ds区元素;
d.H所在族的外围电子排布式为ns2np2,属于p区元素;
(5)短周期中某种元素的最高价氧化物1mol与12molNaOH恰好完全反应生成正盐,该元素在元素周期表中的位置为
查看习题详情和答案>>
| A | B | C | D | E | |||||||||||||
| F | G | H | |||||||||||||||
| I | J | K | |||||||||||||||
| L | |||||||||||||||||
| M | N | ||||||||||||||||
| O | |||||||||||||||||
(1)I的元素符号为
Sc
Sc
,K的元素名称为镓
镓
.(2)写出基态时J元素原子的电子排布式
1s22s22p63s23p63d64s2
1s22s22p63s23p63d64s2
,N元素原子的简化电子排布式[Xe]4f145d106s26p5
[Xe]4f145d106s26p5
.(3)下列对比正确的是
cd
cd
.a.原子半径H>G>B>A; b.第一电离能E>D>C>B;
c.电负性A>H>G>K; d.最高价氧化物的水化物酸性B>A>H>G;
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是
bc
bc
.a.L位于元素周期表中第五周期、ⅠA族,属于s区元素;
b.O位于元素周期表中第七周期、ⅧB族,属于d区元素;
c.M的外围电子排布式为6s1,属于ds区元素;
d.H所在族的外围电子排布式为ns2np2,属于p区元素;
(5)短周期中某种元素的最高价氧化物1mol与12molNaOH恰好完全反应生成正盐,该元素在元素周期表中的位置为
三
三
周期ⅤA
ⅤA
族.
下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
试回答下列问题:
(1)I的元素符号为______,K的元素名称为______.
(2)写出基态时J元素原子的电子排布式______,N元素原子的简化电子排布式______.
(3)下列对比正确的是______.
a.原子半径H>G>B>A; b.第一电离能E>D>C>B;
c.电负性A>H>G>K; d.最高价氧化物的水化物酸性B>A>H>G;
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是______.
a.L位于元素周期表中第五周期、ⅠA族,属于s区元素;
b.O位于元素周期表中第七周期、ⅧB族,属于d区元素;
c.M的外围电子排布式为6s1,属于ds区元素;
d.H所在族的外围电子排布式为ns2np2,属于p区元素;
(5)短周期中某种元素的最高价氧化物1mol与12molNaOH恰好完全反应生成正盐,该元素在元素周期表中的位置为______周期______族.
查看习题详情和答案>>
| A | B | C | D | E | |||||||||||||
| F | G | H | |||||||||||||||
| I | J | K | |||||||||||||||
| L | |||||||||||||||||
| M | N | ||||||||||||||||
| O | |||||||||||||||||
(1)I的元素符号为______,K的元素名称为______.
(2)写出基态时J元素原子的电子排布式______,N元素原子的简化电子排布式______.
(3)下列对比正确的是______.
a.原子半径H>G>B>A; b.第一电离能E>D>C>B;
c.电负性A>H>G>K; d.最高价氧化物的水化物酸性B>A>H>G;
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是______.
a.L位于元素周期表中第五周期、ⅠA族,属于s区元素;
b.O位于元素周期表中第七周期、ⅧB族,属于d区元素;
c.M的外围电子排布式为6s1,属于ds区元素;
d.H所在族的外围电子排布式为ns2np2,属于p区元素;
(5)短周期中某种元素的最高价氧化物1mol与12molNaOH恰好完全反应生成正盐,该元素在元素周期表中的位置为______周期______族.
查看习题详情和答案>>