摘要:(三).金属的冶炼 1.金属冶炼主要是指将金属氧化物转化为金属的过程.在金属氧化物中加入还原剂.夺取金属氧化物中的氧.从而使其还原成全属单质. 2.可以作还原剂的物质主要有 碳 . 一氧化碳 和 氢气 . (1).木炭和氧化铜粉末在高温下的反应: ∆ C + 2CuO === 2Cu + CO2 实验现象:黑色固体逐渐变为红色.澄清石灰水变浑浊. (2).从孔雀石中冶炼铜: ①孔雀石的主要成分为碱式碳酸铜.为绿色粉末. ∆ ②孔雀石加热: Cu2(OH)2CO3 === 2CuO + H2O + CO2 ∆ ③氢气还原氧化铜: H2 + CuO === Cu + H2O 现象:黑色粉末状固体逐渐变为红色.试管口有水珠生成. 操作注意事项:实验开始时需先通一会氢气.再加热氧化铜.防止氢气与空气混合加热时试管爆裂,实验停止后.要继续通人氢气.直到试管冷却为止.防止灼热的铜被空气中的氧气氧化成氧化铜. 高温 (3).一氧化碳还原氧化铁:3CO+Fe2O3 ===== 2Fe + 3CO2 操作注意事项:实验最好在通风橱中进行. 实验时应该先通-会一氧化碳.以排除试管中的空气.防止一氧化碳与空气混合加热时引起爆炸.多余的一氧化碳不能直接排到空气中.应对着火焰烧掉. 3.含氧化合物里的氧被夺取的反应.叫做还原反应,能从氧化物中夺取氧的能力叫做还原性.具有还原性的物质可作还原剂.如碳.一氧化碳和氢气等. 重要提示:氢气还原氧化铜的实验装置中容易出现的典型错误: (a)试管口高于试管底.应使试管口略低于试管底.防止反应生成的水倒流. (b)试管口加了胶塞. 试管口不能加胶塞.否则气体排不出.容易造成试管炸裂. (c)导管略伸入试管口.应使导管贴试管上壁伸入试管底部. 4.有关纯度问题的汁算 (1)根据混合物质量及其纯度.计算纯净物质量: 纯净物质量 = 混合物质量 × 纯度 (2)根据纯净物的质量.求出其中组成元素的质量分数. 组成元素的质量分数 = 某组成元素的质量 ÷ 纯净物的质量 (3)求工业产品中的含杂质的物质的质量 混合物质量 = 纯净物质量 ÷ 纯度 (四). 化合物之间的转化 1.鸡蛋外壳与稀盐酸的反应:CaCO3 + 2HCl ===CaCl2 + H2O + CO2 现象:一会下沉.一会又浮上来.不断地上下沉浮. 物质转化的规律 (1)金属 金属氧化物 碱 盐.如 Ca CaO Ca(OH)2 CaCO3. (2)非金属 非金属氧化物 酸 盐.如 燃烧 C CO2 H2CO3 Na2 CO3. (3)金属 + 非金属 无氧酸盐.如2Na + Cl2 === 2NaCl (4)金属氧化物 + 非金属氧化物 含氧酸盐.如Na2O + CO2 === Na2CO3 (5)酸 + 碱 盐 + 水.如HCl + NaOH === NaCl + H2O (6)盐 + 盐 新盐 + 新盐.如NaCl + AgNO3 === AgCl + NaNO3 (7)金属氧化物 + 酸 盐 + 水.如Fe2O3 + 6HCl === 2FeCl3 + 3H2O (8)非金属氧化物 + 碱 盐 + 水.如SO2 + 2NaOH === Na2SO3 + H2O (9)金属 + 盐 新全属 + 新盐.如Fe + CuSO4 === Cu + FeSO4 (10)金属 + 酸 盐 + 氢气.如Fe +2HCl === FeCl2 + H2 1. 盐跟金属的反应.要求参加反应的盐必须是可溶的.由于盐跟金属的反应一般都在水溶液中进行.因此一些非常活泼能够跟水发生反应的金属也不符合要求. 2. 盐与盐的反应.盐与碱的反应除必须满足复分解反应的条件(生成物中有气体.水或沉淀)外.其反应物必须都可溶.
网址:http://m.1010jiajiao.com/timu3_id_3984433[举报]
金属是一类重要的材料,人类的生活和生产都离不开金属.下图表示了金属活动性顺序表中铜、锡、铁和铝元素被人类大规模开发、利用的大致年限.
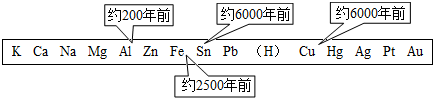
(1)根据图中数据和有关的化学知识,你认为金属大规模开发、利用的先后顺序跟下列哪些因素有关 .
①金属冶炼的难易程度 ②金属的导电性 ③金属的活动性 ④地壳中金属元素的含量
(2)钢铁的生产和使用是人类文明和社会进步的一个重要标志.请你写出一氧化碳在高温条件下把铁从赤铁矿里还原出来的化学方程式 .

(3)每年世界上钢铁的产量很高,但钢铁的锈蚀也给人类带来了巨大的损失,铁在空气中锈蚀,实际上是铁跟 等物质相互作用的结果.自行车的主要材料钢铁易生锈,请你为右图标示的自行车部件各设计一种不同的、合理的防锈方法:a.三脚架 、b.辐条 、c.链条 .
(4)铝的活动性比铁强,但铝与空气中却表现出良好的抗蚀性,其原因 .
(5)世界卫生组织把金属铝列为食品污染源之一,指出每人每日铝的安全摄入量应控制在4毫克以下.某饮食店用1000克面粉、4克明矾[化学式为KAl(SO4)2?12H2O]、小苏打、食盐等辅料加适量水,烹炸得油条24根,平均每根50克.问:
①明矾属于相对分子质量为 ;
②明矾中钾元素、铝元素、硫元素、氧元素、氢元素的质量比为 .
③已知明矾中铝元素的质量分数为5.7%,求4克明矾中铝元素的质量.
④若在烹炸油条过程中铝元素不损失,某人一天吃一根油条,他摄入铝的量是否超过安全摄入量.
⑤请再举一种日常生活中会导致铝进入人体的途径: .
查看习题详情和答案>>

(1)根据图中数据和有关的化学知识,你认为金属大规模开发、利用的先后顺序跟下列哪些因素有关
①金属冶炼的难易程度 ②金属的导电性 ③金属的活动性 ④地壳中金属元素的含量
(2)钢铁的生产和使用是人类文明和社会进步的一个重要标志.请你写出一氧化碳在高温条件下把铁从赤铁矿里还原出来的化学方程式

(3)每年世界上钢铁的产量很高,但钢铁的锈蚀也给人类带来了巨大的损失,铁在空气中锈蚀,实际上是铁跟
(4)铝的活动性比铁强,但铝与空气中却表现出良好的抗蚀性,其原因
(5)世界卫生组织把金属铝列为食品污染源之一,指出每人每日铝的安全摄入量应控制在4毫克以下.某饮食店用1000克面粉、4克明矾[化学式为KAl(SO4)2?12H2O]、小苏打、食盐等辅料加适量水,烹炸得油条24根,平均每根50克.问:
①明矾属于相对分子质量为
②明矾中钾元素、铝元素、硫元素、氧元素、氢元素的质量比为
③已知明矾中铝元素的质量分数为5.7%,求4克明矾中铝元素的质量.
④若在烹炸油条过程中铝元素不损失,某人一天吃一根油条,他摄入铝的量是否超过安全摄入量.
⑤请再举一种日常生活中会导致铝进入人体的途径:
铁的冶炼是钢铁工业的基础.
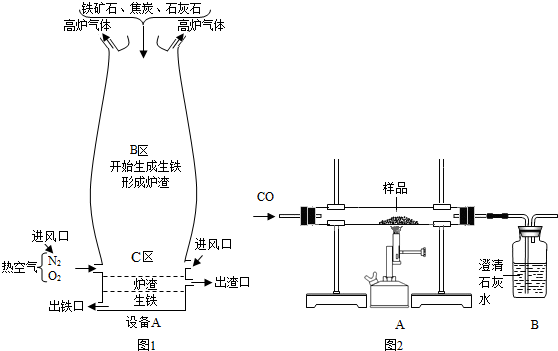
(Ⅰ)如图1是教材中炼铁高炉及炉内化学变化过程示意图,若图中采用的铁矿石的主要成分为氧化铁,请写出B区和C区所发生主要反应的化学方程式:(1)B区
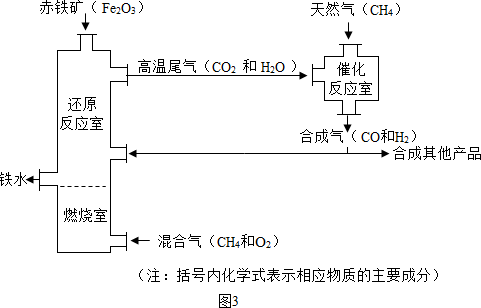
(Ⅱ)竖炉炼铁也是一种重要的炼铁方法,其工艺流程如图2所示.
(3)该工艺流程中,甲烷的作用是
(4)该工艺流程中,可循环利用的物质是
(Ⅲ)金属在活动性顺序里的位置越后,其化合物越不稳定,所以它的氧化物越容易被还原.
(5)请在下列①②中各写一个化学方程式,③中写出还原金属氧化物的方法.

(Ⅳ)某兴趣小组同学利用图3装置进行相关实验,测定样品的组成:
(6)若样品由氧化铁、氧化亚铁和四氧化三铁中的一种或几种组成,待充分反应后,实验数据记录如下:
请回答下列问题:
①兴趣小组同学经过讨论后认为应选用样品质量和装置A中玻璃管和固体的总质量的变化来计算,而不选用装置B的质量的变化来计算,理由是
②该样品所有可能的组成是
查看习题详情和答案>>


(Ⅰ)如图1是教材中炼铁高炉及炉内化学变化过程示意图,若图中采用的铁矿石的主要成分为氧化铁,请写出B区和C区所发生主要反应的化学方程式:(1)B区
3CO+Fe2O3
2Fe+3CO2
| ||
3CO+Fe2O3
2Fe+3CO2
(2)C区
| ||
C+O2
CO2
| ||
C+O2
CO2
、
| ||
2C+CO2
2CO
| ||
2C+CO2
2CO
.
| ||
(Ⅱ)竖炉炼铁也是一种重要的炼铁方法,其工艺流程如图2所示.
(3)该工艺流程中,甲烷的作用是
燃烧产生热量
燃烧产生热量
、做生产合成气的原料
做生产合成气的原料
,冶炼出的铁水属于混合物
混合物
(填“纯净物”或“混合物”).(4)该工艺流程中,可循环利用的物质是
CO2和H2O(高温尾气)
CO2和H2O(高温尾气)
.(Ⅲ)金属在活动性顺序里的位置越后,其化合物越不稳定,所以它的氧化物越容易被还原.
(5)请在下列①②中各写一个化学方程式,③中写出还原金属氧化物的方法.

(Ⅳ)某兴趣小组同学利用图3装置进行相关实验,测定样品的组成:
(6)若样品由氧化铁、氧化亚铁和四氧化三铁中的一种或几种组成,待充分反应后,实验数据记录如下:
| 样品质量 | 装置A中玻璃管和固体的总质量 | 装置B的质量 |
| 2.32g | 反应前55.72g | 反应前 281.00g |
| 反应后55.08g | 反应后 281.56g |
①兴趣小组同学经过讨论后认为应选用样品质量和装置A中玻璃管和固体的总质量的变化来计算,而不选用装置B的质量的变化来计算,理由是
装置B不能将反应产生的CO2全部吸收
装置B不能将反应产生的CO2全部吸收
.②该样品所有可能的组成是
Fe3O4;Fe2O3、FeO;Fe3O4、Fe2O3、FeO
Fe3O4;Fe2O3、FeO;Fe3O4、Fe2O3、FeO
. 金属的应用非常广泛.
金属的应用非常广泛.(1)生活中常用铁锅炒菜,主要利用了铁的性质是(填序号)
A
A
.A.导热性 B.导电性 C.延展性 D.有金属光泽
(2)下列不能与铁发生反应的是(填序号)
D
D
.A.氧气 B.稀盐酸 C.硫酸铜溶液 D.氯化锌溶液
(3)工业上,常在高温下用一氧化碳把铁从铁矿石中还原出来.若用磁铁矿(主要成分为四氧化三铁)冶炼铁,写出发生反应的化学方程式
4CO+Fe3O4
3Fe+4CO2
| ||
4CO+Fe3O4
3Fe+4CO2
.
| ||
冶炼钨的一个阶段是用炭、氢气等还原剂在高温条件下把氧化钨 (WO3)还原为金属钨.为了获得纯度较高的钨,应选择
氢气
氢气
(选填“氢气”或“炭”)作还原剂,写出所选物质还原氧化钨的化学方程式3H2+WO3
W+3H2O
| ||
3H2+WO3
W+3H2O
.
| ||
铁是生活中常用的金属.图是某“取暖片”外包装的图片.该“取暖片”中发热剂主要成分有铁粉、活性炭、氯化钠、水等,其发热是利用铁生锈时会放热.发热剂需接触到空气才会发热,原因是铁要与
氧气
氧气
、水
水
等物质共同作用才会生锈.金属是一类重要的材料,人类的生活和生产都离不开金属.如图表示了金属活动性顺序表中铜、锡、铁和铝元素被人类大规模开发、利用的大致年限.

(1)根据图中数据和有关的化学知识,你认为金属大规模开发、利用的先后顺序跟下列哪些因素有关
①金属冶炼的难易程度 ②金属的导电性 ③金属的活动性 ④地壳中金属元素的含量
(2)钢铁的生产和使用是人类文明和社会进步的一个重要标志.请你写出一氧化碳在高温条件下把铁从赤铁矿里还原出来的化学方程式
(3)每年世界上钢铁的产量很高,但钢铁的锈蚀也给人类带来了巨大的损失,铁在空气中锈蚀,实际上是铁跟
(4)铝的活动性比铁强,但铝与空气中却表现出良好的抗蚀性,其原因
查看习题详情和答案>>

(1)根据图中数据和有关的化学知识,你认为金属大规模开发、利用的先后顺序跟下列哪些因素有关
①③
①③
.①金属冶炼的难易程度 ②金属的导电性 ③金属的活动性 ④地壳中金属元素的含量
(2)钢铁的生产和使用是人类文明和社会进步的一个重要标志.请你写出一氧化碳在高温条件下把铁从赤铁矿里还原出来的化学方程式
3CO+Fe2O3
2Fe+3CO2
| ||
3CO+Fe2O3
2Fe+3CO2
.
| ||

(3)每年世界上钢铁的产量很高,但钢铁的锈蚀也给人类带来了巨大的损失,铁在空气中锈蚀,实际上是铁跟
水和氧气
水和氧气
等物质相互作用的结果.自行车的主要材料钢铁易生锈,请你为右图标示的自行车部件各设计一种不同的、合理的防锈方法:a.三脚架喷涂油漆
喷涂油漆
、b.辐条电镀
电镀
、c.链条涂油
涂油
.(4)铝的活动性比铁强,但铝与空气中却表现出良好的抗蚀性,其原因
铝的表面生成致密的氧化铝薄膜,隔绝了铝与空气的接触
铝的表面生成致密的氧化铝薄膜,隔绝了铝与空气的接触
.