网址:http://m.1010jiajiao.com/timu3_id_3984432[举报]
(1)H2SO3转化为硫酸是酸雨形成的重要过程之一,写出其反应的化学方程式:
(2)Ba2+有剧毒.我市曾发生一起“毒烧饼”事件,起因是烧饼摊主在制作烧饼的过程中误将有毒化工原料碳酸钡当作干粉使用,导致多人中毒.试用化学方程式说明“毒烧饼”事件中的中毒原因
医生往往让其服用
(3)常温下,将铁棒置于浓硫酸中,无明显现象,课本上解释为发生了钝化,但有人认为未发生反应.为验证此过程,某同学经过思考,设计了如下实验:将经浓硫酸处理过的铁棒洗净后置于CuSO4溶液中,若铁棒表面
(4)美国和日本正在研究用Na2SO3吸收法作为治理SO2污染的一种新方法,其原理为(用化学方程式表示):
(5)为进一步减少SO2的污染并变废为宝,我国正在探索在一定条件下用CO还原SO2得到单质硫的方法来除去SO2.写出该反应的化学方程式:
(6)制取硫酸铜的方法有两种:
方法一:2Cu+O2
| ||
方法二:Cu+2H2SO4(浓)
| ||
方法一与方法二相比,其优点是:
(7)硅是无机非金属材料的主角.请你举出两种含硅的材料名称
(8)大量使用化石燃料,最直接的危害是造成大气污染,如“温室效应”、“酸雨”等都与大量使用化石燃料有关.为了防治酸雨,降低煤燃烧时向大气排放的SO2,工业上将生石灰和含硫煤混合后使用.请写出燃烧时,有关“固硫”(不使硫的化合物进入大气)反应的化学方程式
(9)生活中处处有化学,缺铁性贫血患者应补充Fe2+,通常以硫酸亚铁的形式,而硫酸铁则无这种药效.当用硫酸亚铁制成药片时外表包有一层特殊的糖衣,这层糖衣的作用是
(2)二氧化钛可作光催化剂,能将居室污染物甲醛、苯、二甲苯等有害物质转化为二氧化碳和水,达到无害化。下列有关甲醛、苯、二甲苯、二氧化碳及水的说法正确的是__。
A.苯与B3N3H6互为等电子体,分子中所有原子共平面,且都有三种二氯代物
B.二氧化碳、甲醛、氯仿( CHCl3)中的碳原子分别采取sp.sp2和sp3杂化
C.对二甲苯是非极性分子,邻二甲苯和间二甲苯都是极性分子
D.氨比甲醛易溶于水,是因为甲醛与水分子间不能形成氢键
(3)日常生活中广泛使用的不锈钢就是含铬的合金,铬原子中未成对电子数为___。
(4)①短周期的某主族元素M的逐级电离能情况如下图A所示,则M元素在形成化合物时,表现的主要化合价为___ 价。
②第三周期八种元素的单质熔点高低的情况如下图B所示,其中序号“8”代表___(填元素符号),其中电负性最大的是____(填图B中的序号)。


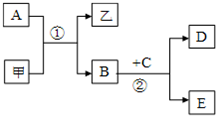 图所示的转化关系中,甲、乙及A、B、C、D、E均为中学常见的化学物质,其中甲、乙为化合物,A、B、D为单质.
图所示的转化关系中,甲、乙及A、B、C、D、E均为中学常见的化学物质,其中甲、乙为化合物,A、B、D为单质.(1)若A、B为金属单质;在常温下C为无色液体;甲常作红色油漆的颜料;乙溶于烧碱溶液.则甲是
| ||
| ||
(2)若A、B为同主族非金属单质;E的水溶液呈碱性,向其中加入过量稀盐酸,生成白色胶状沉淀.则甲可用作制取
| ||
| ||
 图所示的转化关系中,甲、乙及A、B、C、D、E均为中学常见的化学物质,其中甲、乙为化合物,A、B、D为单质.
图所示的转化关系中,甲、乙及A、B、C、D、E均为中学常见的化学物质,其中甲、乙为化合物,A、B、D为单质.
(1)若A、B为金属单质;在常温下C为无色液体;甲常作红色油漆的颜料;乙溶于烧碱溶液.则甲是______(填俗称);乙溶于烧碱溶液的离子方程式为______;反应②的化学方程式为______.
(2)若A、B为同主族非金属单质;E的水溶液呈碱性,向其中加入过量稀盐酸,生成白色胶状沉淀.则甲可用作制取______(填两种)的原料;向E溶液中通入过量二氧化碳,反应的离子方程式为______;A与浓硫酸反应的化学方程式为______.
查看习题详情和答案>>
碳和氮的化合物与人类生产、生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应: Ni(s)+4CO(g) 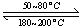 Ni(CO)4(g),
Ni(CO)4(g), H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是 ?? (填字母编号)。
H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是 ?? (填字母编号)。
A.增加Ni的量可提高CO的转化率,Ni的转化率降低
B.缩小容器容积,平衡右移, H减小
H减小
C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D.当4v[Ni(CO)4]=v(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
(2)CO与镍反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫。
已知:C(s)+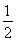 O2(g)=CO(g)??
O2(g)=CO(g)??  H=-Q1 kJ
H=-Q1 kJ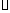 mol-1
mol-1
C(s)+ O2(g)=CO2(g)???  H=-Q2 kJ
H=-Q2 kJ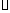 mol-1
mol-1
S(s)+O2(g)=SO2(g)????  H=-Q3 kJ
H=-Q3 kJ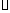 mol-1
mol-1
则SO2(g)+2CO(g)=S(s)+2CO2(g)??  H=????????? 。
H=????????? 。
(3)金属氧化物可被一氧化碳还原生成金属单质和二氧化碳。图28(3)是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时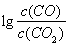 与温度(t)的关系曲线图。
与温度(t)的关系曲线图。
700oC时,其中最难被还原的金属氧化物是???????? (填化学式),用一氧化碳还原该金属氧化物时,若反应方程式系数为最简整数比,该反应的平衡常数(K)数值等于 ?????????? 。
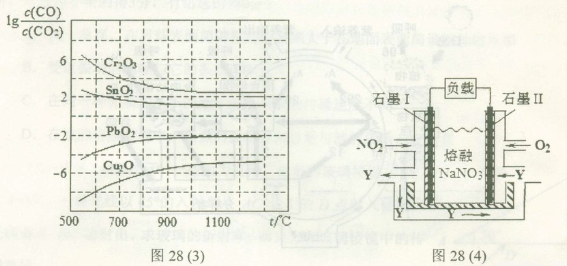
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如上图28(4)所示。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为?????????????? 。
若该燃料电池使用一段时间后,共收集到20mol Y,则理论上需要消耗标准状况下氧气的体积为?? ??? L。
查看习题详情和答案>>