网址:http://m.1010jiajiao.com/timu3_id_3983796[举报]
大气固氮属于自然固氮,合成氨是目前人工固氮的主要方法。科学家一直致
力“人工固氮”新方法的研究。
(1)有关大气固氮(以N2+O2![]() 2NO为例)、人工固氮(以为N2+3H2
2NO为例)、人工固氮(以为N2+3H2![]() 2NH3 为例)反应的平衡常数
2NH3 为例)反应的平衡常数![]() 的值如下表。
的值如下表。
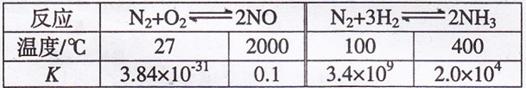
下列说法正确的是 填字母
a.大气固氮与人工固氮都是放热反应 b.人类模拟大气固氮无现实意义
c.寻找在常温下合成氨的高效催化剂是目前人工固氮的新方向
d.在常温下,人工固氮非常容易进行
(2)已知:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4KJ.mol-1
2NH3(g) △H=-92.4KJ.mol-1
2H2(g) + O2(g) = 2H2O(l) △H=-571.6KJ.mol-1
据报道,在常温、常压、光照、催化剂的条件下,![]() 可以与水反应,则反应
可以与水反应,则反应
N2(g) + 3H2O(l)= 2NH3(g) +3/2O2(g)的 △H= KJ.mol-1
(3)某研究小组在673 K、30 MPa下,在体积为VL的密闭容器中进行反应:,N2(g)+3H2(g)![]() 2NH3(g)其n(H2)和n(NH3)随时间变化的关系如图所示。
2NH3(g)其n(H2)和n(NH3)随时间变化的关系如图所示。
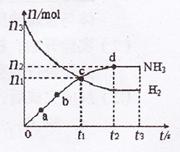
①下列叙述正确的是 填字母
A.点a的正反应速率比点b的大
B.点c处反应达到化学平衡状态
C.若如时由673 K升至773 K,则n(H2)将增大
②从开始到平衡时反应的平均速率(以H2的浓度变化表示)v(H2)= .
③若开始时n(N2)= n(H2),则反应的平衡常数K= (用代数式表示).
查看习题详情和答案>>根据元素周期表中第四周期元素的相关知识,回答下列问题:
(1)第四周期元素的基态原子的电子排布中4s轨道上只有1个电子的元素有________种;写出Cu+的核外电子排布式________。
(2)按电子排布,可将周期表里的元素划分成五个区域,第四周期元素中属于s区的元素有________种,属于d区的元素有________种。
(3)CaO晶胞如右图所示,CaO晶体中Ca2+的配位数为________;CaO的焰色反应为砖红色,许多金属或它们的化合物都可以发生焰色反应,其原因是________________

(4)由叠氮化钾(KN3)热分解可得纯N2:2KN3(s)=2K(l)+3N2(g),下列有关说法正确的是________(填选项字母)。
A.NaN3与KN3结构类似,前者晶格能较小
B.晶体钾的晶胞结构如图所示: ,每个晶胞中分摊2个钾原子
,每个晶胞中分摊2个钾原子
C.氮的第一电离能大于氧
D.氮气常温下很稳定,是因为氮的电负性小
(5)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂。O2在其催化作用下,可将CN-氧化成CNO-。CN-的电子式为_______,CNO-的中心原子的杂化方式为_______
(6)在CrCl3溶液中,一定条件下存在组成为[CrCln(H2O)6-n]x+ (n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应:[CrCln(H2O)6-n]x++xR-H Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1 NaOH溶液25.00 mL,则该配离子的化学式为_______。
Rx[CrCln(H2O)6-n]+xH+。将含0.0015 mol[CrCln(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1 NaOH溶液25.00 mL,则该配离子的化学式为_______。
查看习题详情和答案>>

(1)下列有关说法正确的是
a.生物燃料本质上能量来源于太阳能
b.由纤维素水解获得的乙醇属生物质能
c.生物质裂解获得的汽油、柴油等属于纯净物
d.由植物秸秆等发酵获得的沼气,主要成分是甲烷
e.生物质资源是一种污染小的可再生能源
(2)由生物质能获得的CO和H2当两者1:1催化反应,其原子利用率达100%,合成的物质可能是
a.汽油 b.甲醇 c.甲醛 d.乙酸
(3)将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一.煤转化为水煤气的主要化学反应为:C+H2O(g)
| ||
C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2═CO2(g)△H=-393.5 kJ?mol-1;
H2(g)+
| 1 |
| 2 |
CO(g)+
| 1 |
| 2 |
请你根据以上数据,写出C(s)与水蒸气反应生成CO和H2的热化学方程式:
(4)燃油中所含硫以二硫醚的形式存在,工业上常用催化加氢的方法脱硫,然后综合利用生产硫酸.如二硫丙醚 ( C3H7-S-S-C3H7) 脱硫综合利用的有关反应为:
C3H7-S-S-C3H7(g)+3H2(g)═2C3H8(g)+2H2S(g);△H1
| 化学键 | C-C | C-H | H-H | S-H | S-S | S-C |
| 键能/kJ.mol-1 | a | b | c | d | e | f |
则△H1=
现有一种以黄铜矿和硫磺为原料制取铜和其他产物的新工艺,原料的综合利用率较高.其主要流程如下:
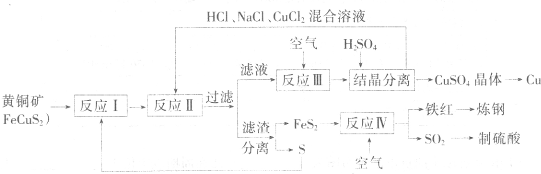
注:反应Ⅱ的离子方程式为Cu2++CuS+4Cl-=2[CuCl2]-+S
请回答:
(1)从黄铜矿冶炼粗铜的传统丁艺是将精选后的富铜矿砂与空气在高温下煅烧,使其转变为铜、这种方法的缺点是
(2)反应Ⅰ的产物为(填化学式)
(3)反应Ⅲ的离子方程式为
(4)一定温度下,在反应Ⅲ所得的溶液中加入稀硫酸,可以析出硫酸铜晶体,其原因是
(5)黄铜矿中Fe的化合价为+2,关于反应.8CuFeS2+21O2
| ||
A.反应中被还原的元素只有氧
B.反应生成的SO2直接排放会污染环境
C.SO2既是氧化产物又是还原产物
D.当有8mol铜生成时,转移电子数目为100NA
(6)某硫酸厂为测定反应IV所得气体中SO2的体积分数,取280mL(已折箅成标准状况)气体样品与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000mol/L 的 K2Cr2O2标准溶液滴定至终点,消耗K2Cr2O3溶液25.00ml.
已知:Cr2O32-+Fe2++H+→Cr3++Fe3++H2O(未配平)
①SO2通入Fe2(SO4)3溶液,发生反应的离子方程式为
②反应Ⅳ所得气体中SO2的体积分数为
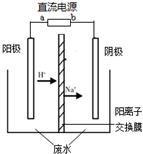 (2012?海淀区二模)最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、电解阳极发生反应,转化为乙醇和乙酸,总反应为:2CH3CHO+H2O═CH3CH2OH+CH3COOH实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示.
(2012?海淀区二模)最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、电解阳极发生反应,转化为乙醇和乙酸,总反应为:2CH3CHO+H2O═CH3CH2OH+CH3COOH实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示.(1)若以甲烷燃料电池为直流电源,则燃料电池中b极应通入
(2)电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体.电极反应如下:
阳极:①4OH--4e-═O2↑+2H2O
②
阴极:①
②CH3CHO+2e-+2H2O═CH3CH2OH+2OH-
(3)电解过程中,阴极区Na2SO4的物质的量
(4)电解过程中,某时刻测定了阳极区溶液中各组分的物质的量,其中Na2SO4与CH3COOH的物质的量相同.下列关于阳极区溶液中各微粒浓度关系的说法正确的是
a.c(Na+)不一定是c(SO42-)的2倍
b.c(Na+)=2c(CH3COOH)+2c(CH3COO-)
c.c(Na+)+c(H+)=c(SO42-)+c(CH3COO-)+c(OH-)
d.c(Na+)>c(CH3COOH)>c(CH3COO-)>c(OH-)
(5)已知:乙醛、乙醇的沸点分别为20.8℃、78.4℃.从电解后阴极区的溶液中分离出乙醇粗品的方法是
(6)在实际工艺处理中,阴极区乙醛的去除率可达60%.若在两极区分别注入1m3乙醛的含量为3000mg/L的废水,可得到乙醇