网址:http://m.1010jiajiao.com/timu3_id_3981566[举报]
新的《环境空气质量标准》将于2016年1月1日在我国全面实施。据此,环境空气质量指数(AQI)日报和实时报告包括了SO2、NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。
(1)汽车排出的尾气中含有CO和NO等气体,用化学方程式解释产生NO的原因________________________________________
(2)汽车排气管内安装的催化转化器,可使汽车尾气中的主要污染物转化为无毒的大气循环物质。已知:
N2(g)+O2(g)===2NO(g) ΔH=+180.5 kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ·mol-1
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
则反应2NO(g)+2CO(g)??N2(g)+2CO2(g)的ΔH=________kJ·mol-1;该反应的ΔS________0(填“>”“<”或“=”)。
(3)将0.20 mol NO和0.10 mol CO充入一个容积恒定为1 L的密闭容器中,在不同条件下反应过程中部分物质的浓度变化状况如图所示。
①计算产物N2在6~9 min时的平均反应速率v(N2)=________mol·L-1·min-1;
②第12 min时改变的反应条件为________(填“升温”或“降温”);
③计算反应在第24 min时的平衡常数K=________。若保持温度不变,再向容器中充入CO、N2各0.060 mol,平衡将________移动(填“正向”“逆向”或“不”)。
(4)环境监测中还可用沉淀法测定空气中含有较高浓度SO2的含量,经查得一些物质在20 ℃的数据如下表:
| 溶解度(S)/g | 溶度积(Ksp) | ||
| Ca(OH)2 | Ba(OH)2 | CaSO3 | BaSO3 |
| 0.160 | 3.89 | 6.76×10-3 | 5.48×10-9 |
①吸收SO2最合适的试剂是________[填“Ca(OH)2”或“Ba(OH)2”]溶液;
②在20 ℃时,向CaSO3悬浊液中滴加适量的BaCl2溶液,当CaSO3向BaSO3的转化达到平衡时,溶液中的
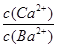 =____________(写出表达式即可)。
查看习题详情和答案>>
=____________(写出表达式即可)。
查看习题详情和答案>>
钙是人体神经、骨骼系统等功能正常运作所必需的常量元素。某药业公司生产的钙片包装上有如下说明:
| 性状 | 本品为白色片 |
| 贮藏 | 密封,干燥处保存 |
| 规格 | 每片含碳酸钙0.5 g (相当于钙 0.2 g) |
| 包装 | 固体药用塑料瓶包装,每瓶100片 |
| 生产批号 | |
| 生产日期 | |
| 有效期至 |
某学习小组为了确定钙片中碳酸钙的含量是否符合包装说明上的规格,进行如下实验:
①取一片钙片研碎后加入足量稀盐酸,充分反应后过滤并洗涤。
②取①中滤液加入足量的(NH4)2C2O4溶液,使Ca2+全部转化为CaC2O4沉淀,过滤并洗涤。
③取②中沉淀完全溶于强酸中,得到草酸(H2C2O4),并稀释成1.000 L溶液。
④取③中溶液20.00 mL ,用0.0050 mol/L酸性高锰酸钾溶液滴定,恰好完全反应时,消
耗了12.00mL酸性高锰酸钾溶液,反应的离子方程式是(未配平)
_____MnO4-+_____H2C2O4+_____H+――_____Mn2++_____CO2↑ +______ H2O
(1)配平该反应的离子方程式(将化学计量数填于空白处)。
(2)过滤操作中需要用到的玻璃仪器的名称是___________________________。
(3)简述步骤②中沉淀是否洗涤干净的方法(写出操作、现象和结论):___________________________________________________________________________。
(4)滴定时是否需要指示剂?_________(填“是”或“否”),理由是___
(5)学习小组根据以上实验,计算出钙片中含碳酸钙的质量是___________g/片,与包装说明相比较,分析产生该实验结果可能的原因是_________________
查看习题详情和答案>>(1)滴定时是否需要指示剂?答:_________,理由是______________________________。
(2)试计算每片钙剂中钙元素有多少毫克。
查看习题详情和答案>>产品标准 产品等级 配料 碘含量(以Ⅰ计算) 分装日期 分装企业 | GB5461 一级 食盐、碘酸钾、抗结剂 20—50mg/kg 2007.1.25
|
1.上述精制盐属于_________(填“纯净物”或“混合物”)。
2.如果含碘量达到50mg/kg,则精制食盐中碘酸钾的质量分数为___________。
3.配平下列化学方程式。
______KIO3+______KI+______H2SO4![]() ______K2SO4+______I2+______H2O
______K2SO4+______I2+______H2O
(1)反应中作氧化剂的是________;
(2)当溶液中生成0.5 mol I2时,电子转移总数为________________个。
4.已知:I2+2![]()
![]() 2I-+
2I-+![]() 某学生测定食用精盐的碘含量,步骤为:
某学生测定食用精盐的碘含量,步骤为:
a.准确称取W g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3和KI完全反应;
c.以淀粉为指示剂,逐滴加入物质的量浓度为
2.0×10-3mol/L的Na2S2O3溶液10.0mL,恰好完全反应。
(1)判断c中反应恰好完全的依据现象是________________;
(2)b中反应所产生的I2的物质的量是________________mol;
(3)计算:根据以上实验和包装袋上的说明所测精制盐的碘含量(以含W的代数式表示)。
查看习题详情和答案>>氨有着广泛的用途,如可用于化肥、硝酸、合成纤维等工业生产。氨的水溶液中存在电离平衡,常用电离常数Kb和电离度α来定量表示其电离程度。Kb和α常用的测定方法:在一定温度时用酸度计测定一系列已知浓度氨水的pH,可得各浓度氨水对应的c(OH-),然后通过换算求得各对应的α值和Kb值。下面是某中学化学兴趣小组在25℃时测定一系列浓度氨水的pH所对应的c(OH-):
【仪器与试剂】酸度计、50 mL碱式滴定管、100mL烧杯、 0.10 mol·L-1 氨水
【实验数据】(不必填表格)
| 烧杯号 | V氨水 (mL) | V水(mL) | c (NH3·H2O) (mol·L-1) | c(OH-) | Kb | α |
| 1 | 50.00 | 0.00 |
| 1.34×10-3 |
|
|
| 2 | 25.00 | 25.00 |
| 9.48×10-4 |
|
|
| 3 | 5.00 | 45.00 |
| 4.24×10-4 |
|
|
请根据以上信息回答下述问题:
(1)25℃时,氨水的电离常数:Kb![]() ▲ ,通过计算所得的数据和简洁的文字说明电离常数、电离度与弱电解质的初始浓度的关系 ▲ 。
▲ ,通过计算所得的数据和简洁的文字说明电离常数、电离度与弱电解质的初始浓度的关系 ▲ 。
(2)用0.10mol·L—1盐酸分别滴定20.00mL0.10mol·L—1的NaOH溶液和20.00mL0.10mol·L—1
氨水所得的滴定曲线如下:
请指出盐酸滴定氨水的曲线为 ▲ (填A或B),请写出曲线a点所对应的溶液中各离子浓度由大到小的排列顺序 ▲ 。
(3)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧试验机中相关的反应有:
4NH3(g)+3O2(g)= 2N2(g)+6H2O(l) △H1 ①
4NH3(g)+5O2(g)= 4NO(g)+6H2O(l) △H2 ②
4NH3(g)+6NO(g)= 5N2(g)+6H2O(l) △H3 ③
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1= ▲ 。
(4)Allis-Chalmers制造公司发现可以用氨作为燃料电池的燃料。其总反应式为4NH3+3O2=2N2+6H2O,正极上的电极反应式为O2+2H2O+4e—=4OH—,则负极上的电极反应式为 ▲ 。
查看习题详情和答案>>