网址:http://m.1010jiajiao.com/timu3_id_398120[举报]
(共16分)在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
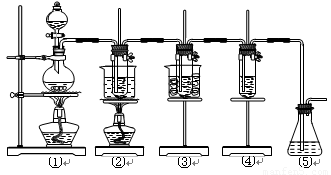
图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过_____________(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_______(填写下列编号字母)的净化装置。
(A)碱石灰 (B)饱和食盐水 (C)浓硫酸 (D)饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是:____________________________。
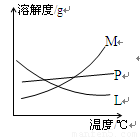
反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是_______(填写编号字母);从②的试管中分离出该晶体的方法是__________(填写实验操作名称)。
(3)本实验中制取次氯酸钠的离子方程式是______________________________________。
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
|
实验现象 |
原因 |
|
溶液最初从紫色逐渐变为_______色 |
氯气与水反应生成的H+使石蕊变色 |
|
随后溶液逐渐变为无色 |
_______________________________ |
|
然后溶液从无色逐渐变为_______色 |
_______________________________ |
查看习题详情和答案>>
(16分)物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识的回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为 。
(2)B为0.1 mol·L-1NaHCO3溶液,在NaHCO3溶液中存在的各种平衡体系为(用离子方程式表示): ;实验测得NaHCO3溶液的pH > 7,请分析NaHCO3溶液显碱性的原因: 。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入 ,目的是 ;
若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为 。
(4)D为含有足量AgCl固体的饱和溶液,氯化银在水中存在沉淀溶解平衡:AgCl(S)Ag+(aq)+ Cl-(aq) 在25℃时,氯化银的Ksp= 1.8×10-10 ;25℃时现将足量氯化银分别放入①100mL蒸馏水中②100mL 0.2 mol·L-1AgNO3溶液中③100mL 0.1 mol·L-1氯化铝溶液中④100mL 0.1 mol·L-1盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是 (填写序号);②中氯离子的浓度为 mol·L-1。
查看习题详情和答案>>
(16分)铁在冷的浓硫酸中能发生钝化。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体。实验室现有下列试剂: 0.01 mol/L 酸性KMnO4溶液、0.1 mol/L KI溶液、3%H2O2溶液、淀粉溶液、蒸馏水。请你协助他们探究所得溶液和气体的成分。
【提出猜想】
Ⅰ.所得溶液中的金属离子可能含有Fe2+和Fe3+中的一种或两种;
Ⅱ.所得气体中可能含有 中的一种或两种。
【实验探究】
|
|
实验操作 |
预期现象 |
结 论 |
|
验证猜想Ⅰ |
步骤①:取少量0.01 mol/L 酸性KMnO4溶液,滴入所得溶液 |
|
|
|
步骤②: |
|
含有Fe3+ |
|
|
验证猜想Ⅱ |
将所得气体通入如下装置 |
|
含有两种气体 |

【问题讨论】
有同学提出,若另外选用KSCN溶液,则仅利用KSCN和H2O2两种溶液即可完成猜想Ⅰ的所有探究,请对该观点进行评价: 。
查看习题详情和答案>>
(共16分)在实验室里可用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。
请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过_____________(填写仪器名称)向烧瓶中加入适量的浓盐酸。实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有_______(填写下列编号字母)的净化装置。
(A)碱石灰 (B)饱和食盐水 (C)浓硫酸 (D)饱和碳酸氢钠溶液
(2)比较制取氯酸钾和次氯酸钠的条件,二者的差异是:____________________________。
反应完毕经冷却后,②的试管中有大量晶体析出。下图中符合该晶体溶解度曲线的是_______(填写编号字母);从②的试管中分离出该晶体的方法是__________(填写实验操作名称)。
(3)本实验中制取次氯酸钠的离子方程式是______________________________________。
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为_______色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | _______________________________ |
| 然后溶液从无色逐渐变为_______色 | _______________________________ |
查看习题详情和答案>>
(20分)早在2004年,国家食品监督局就发出“警惕食品中丙烯酰胺(CH2=CHCONH2)”的公告,丙烯酰胺会在长期炸制食物过程中产生,具有中等毒性,它对人体可造成神经毒性和遗传毒性。已知:有机物H是丙烯酰胺的相邻同系物;A为气态烃,标准状况下密度为2.5g / L,其分子中有2个甲基;F为六元环状化合物。回答下列问题:
(1)写出G的结构简式__________________ K的结构简式_____________________
(2)指明下列反应类型:A→B:___________________E→G:___________________
(3)写出下列化学方程式:
C→D______________________________________________________________
E→F_______________________________________________________________
(4)下列关于丙烯酰胺的说法,不正确的是________(填选项序号)
①丙烯酰胺所有碳、氮原子不可能在一个平面内 ②人们应改善膳食习惯,少食油炸食品
③丙烯酰胺可发生加成和水解反应 ④酰胺类物质其实就是蛋白质
(5)写出有机物H所有同种类别的同分异构体的结构简式:
__________________________________________________________________________