网址:http://m.1010jiajiao.com/timu3_id_3981199[举报]
(16分)实验室由含铁废铜为原料生产胆矾(CuSO4·5H2O)和石膏(CaSO4·2H2O)的实验流程如图所示:
相关物质在不同温度下的溶解度(g/100g水)见下表。
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8[ | 83.8 | 114 |
请回答下列问题:
(1)红褐色滤渣的主要成分是 (写化学式)。
(2)在进行操作I时的最佳温度是 ℃。
(3)从溶液中分离出产品II的操作II应为 、过滤、 、干燥。
(4)取样检验步骤中检验的是Fe3+,检验Fe3+最灵敏的试剂是大家熟知的KSCN,可以检验痕量的Fe3+。还可用KI来检验:2Fe3++2I-2Fe2++I2,有资料认为这可能是一个可逆反应。Fe3+与I-反应后的溶液显深红色,它是I2溶于KI溶液的颜色。为探究该深红色溶液中是否含Fe3+,进而证明这是否是一个可逆反应,试利用实验室常用仪器、用品及以下试剂设计方案并填写位于答题卷的下表。0.1 mol/L的FeCl3、KI、KSCN、NaOH、H2SO4、KMnO4溶液,CCl4,蒸馏水。
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 在试管中加入少量FeCl3溶液和 (填少量、过量)的KI溶液。 | 深红色如期出现 |
| ② | 将试管中的混合溶液转移至 (填仪器)中,倒入一定量的 , 。 |
|
| ③ |
|
|
查看习题详情和答案>>
(16分)实验室由含铁废铜为原料生产胆矾(CuSO4·5H2O)和石膏(CaSO4·2H2O)的实验流程如图所示: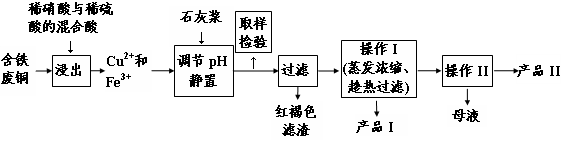
相关物质在不同温度下的溶解度(g/100g水)见下表。
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8[ | 83.8 | 114 |
(1)红褐色滤渣的主要成分是 (写化学式)。
(2)在进行操作I时的最佳温度是 ℃。
(3)从溶液中分离出产品II的操作II应为 、过滤、 、干燥。
(4)取样检验步骤中检验的是Fe3+,检验Fe3+最灵敏的试剂是大家熟知的KSCN,可以检验痕量的Fe3+。还可用KI来检验:2Fe3++2I-
 2Fe2++I2,有资料认为这可能是一个可逆反应。Fe3+与I-反应后的溶液显深红色,它是I2溶于KI溶液的颜色。为探究该深红色溶液中是否含Fe3+,进而证明这是否是一个可逆反应,试利用实验室常用仪器、用品及以下试剂设计方案并填写位于答题卷的下表。0.1 mol/L的FeCl3、KI、KSCN、NaOH、H2SO4、KMnO4溶液,CCl4,蒸馏水。
2Fe2++I2,有资料认为这可能是一个可逆反应。Fe3+与I-反应后的溶液显深红色,它是I2溶于KI溶液的颜色。为探究该深红色溶液中是否含Fe3+,进而证明这是否是一个可逆反应,试利用实验室常用仪器、用品及以下试剂设计方案并填写位于答题卷的下表。0.1 mol/L的FeCl3、KI、KSCN、NaOH、H2SO4、KMnO4溶液,CCl4,蒸馏水。| 编号 | 实验操作 | 预期现象和结论 |
| ① | 在试管中加入少量FeCl3溶液和 (填少量、过量)的KI溶液。 | 深红色如期出现 |
| ② | 将试管中的混合溶液转移至 (填仪器)中,倒入一定量的 , 。 | |
| ③ | | |
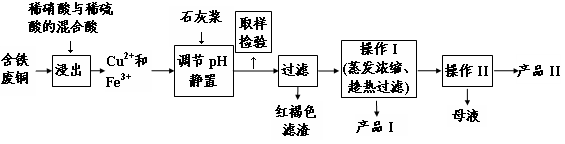
(16分)实验室由含铁废铜为原料生产胆矾(CuSO4·5H2O)和石膏(CaSO4·2H2O)的实验流程如图所示:
相关物质在不同温度下的溶解度(g/100g水)见下表。
|
温度(℃) |
20 |
40 |
60 |
80 |
100 |
|
石膏 |
0.32 |
0.26 |
0.15 |
0.11 |
0.07 |
|
胆矾 |
32 |
44.6 |
61.8[ |
83.8 |
114 |
请回答下列问题:
(1)红褐色滤渣的主要成分是 (写化学式)。
(2)在进行操作I时的最佳温度是 ℃。
(3)从溶液中分离出产品II的操作II应为 、过滤、 、干燥。
(4)取样检验步骤中检验的是Fe3+,检验Fe3+最灵敏的试剂是大家熟知的KSCN,可以检验痕量的Fe3+。还可用KI来检验:2Fe3++2I- 2Fe2++I2,有资料认为这可能是一个可逆反应。Fe3+与I-反应后的溶液显深红色,它是I2溶于KI溶液的颜色。为探究该深红色溶液中是否含Fe3+,进而证明这是否是一个可逆反应,试利用实验室常用仪器、用品及以下试剂设计方案并填写位于答题卷的下表。0.1 mol/L的FeCl3、KI、KSCN、NaOH、H2SO4、KMnO4溶液,CCl4,蒸馏水。
2Fe2++I2,有资料认为这可能是一个可逆反应。Fe3+与I-反应后的溶液显深红色,它是I2溶于KI溶液的颜色。为探究该深红色溶液中是否含Fe3+,进而证明这是否是一个可逆反应,试利用实验室常用仪器、用品及以下试剂设计方案并填写位于答题卷的下表。0.1 mol/L的FeCl3、KI、KSCN、NaOH、H2SO4、KMnO4溶液,CCl4,蒸馏水。
|
编号 |
实验操作 |
预期现象和结论 |
|
① |
在试管中加入少量FeCl3溶液和 (填少量、过量)的KI溶液。 |
深红色如期出现 |
|
② |
将试管中的混合溶液转移至 (填仪器)中,倒入一定量的 , 。 |
|
|
③ |
|
|
查看习题详情和答案>>

(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________,反应的离子方程式为____________________。
(3)实验室溶解该熔融物,下列试剂中最好的是______ (填序号),并说明理由:____________。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。取一定量该熔融物与足量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4 mol/L NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)的关系如图所示。试回答下列问题:

(5)由上述图象分析可知,溶液中结合OH-的能力最强的离子是___________(填离子符号,下同),最弱的离子是____________。
(6)若测定F点沉淀的质量,需对混合物进行的处理是:过滤________、________、称量。
(7)用上图数据计算,熔融物中的两种金属的物质的量之比n(Fe):n(Al)=________。