摘要:下列说法正确的是 A.pH=2的一元酸A和一元酸B.分别加入足量的镁粉.放出H2前者多.则A一定为弱酸.B可能为强酸 B.Li.Na.Mg.Al四种金属中的任三种混合.若1mol混合物与足量盐酸反应可放出1molH2.则其可能的组合只有二种:Li.Mg.Al的混合物或Na.Mg.Al的混合物 C.Fe和浓HNO3反应.若还原产物只有NO2生成.则溶液中的盐只有Fe(NO3)3 D.任意金属阳离子M m+和N n +.若氧化性M m+强于N n+.则金属性M弱于N [ ]12.某化学科研小组研究在其他条件不变时.改变某一条件对化学平衡的影响.得到如下变化规律(图中P表示压强.T表示温度.n表示物质的量): 根据以上规律判断.上列结论正确的是 A.反应Ⅰ:△H>0.P2>P1 B.反应Ⅱ:△H<0.T1<T2 C.反应Ⅲ:△H>0.T2>T1,或△H<0.T2<T1 D.反应Ⅳ:△H<0.T2>T1
网址:http://m.1010jiajiao.com/timu3_id_398009[举报]
下列说法正确的是
A.室温时某溶液的pH<7,则该物质一定是酸或强酸弱碱盐
B.已知室温时,0.1mol·L-1某一元酸HA的电离平衡常数为1×10-7,则该酸的电离度约为0.01%
C.0.02mol·L-1CH3COOH溶液和0.01mol·L-1NaOH溶液等体积混合,则溶液中:
2c(H+) + c(CH3COOH) = 2 c(OH-) + c(CH3COO-)
D.在温度不变的条件下向CaSO4饱和溶液中加入Na2SO4溶液,CaSO4将会析出,但Ksp不会发生改变
查看习题详情和答案>>
下列说法正确的是
| A.室温时某溶液的pH<7,则该物质一定是酸或强酸弱碱盐 |
| B.已知室温时,0.1mol·L-1某一元酸HA的电离平衡常数为1×10-7,则该酸的电离度约为0.01% |
| C.0.02mol·L-1CH3COOH溶液和0.01mol·L-1NaOH溶液等体积混合,则溶液中: 2c(H+) + c(CH3COOH) =" 2" c(OH-) + c(CH3COO-) |
| D.在温度不变的条件下向CaSO4饱和溶液中加入Na2SO4溶液,CaSO4将会析出,但Ksp不会发生改变 |
下列说法正确的是
| A.在滴有酚酞溶液的氨水里,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 |
| B.pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) |
C.室温下向10 mL pH=3的醋酸溶液中加水稀释,溶液中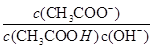 不变 不变 |
| D.在0.1 mol·L-1的硫化钠溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |