摘要:14.下列各物质的溶解度.随温度的升高而减小的是------------------------------------( ) A.氯化铵 B.熟石灰 C.食盐 D.二氧化碳
网址:http://m.1010jiajiao.com/timu3_id_3978678[举报]
下列各种说法中正确的是
[ ]
A.任何物质的饱和溶液,在升高温度时,都会变成不饱和溶液
B.将水加热,溶于其中的空气会放出,说明气体的溶解度随温度升高而减小
C.打开汽水瓶时大量![]() 放出,可知
放出,可知![]() 的溶解度随压强减少而变小
的溶解度随压强减少而变小
D.在25℃时100g水中溶解了25g的NaCl,则NaCl的溶解度是25g
查看习题详情和答案>>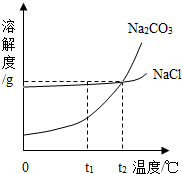 我国某地区有一种“冬天捞碱,夏天晒盐”的传统.这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中会含有少量NaCl.下图为Na2CO3和NaCl的溶解度曲线和部分温度下的溶解度表(单位是克),看图回答下列问题:
我国某地区有一种“冬天捞碱,夏天晒盐”的传统.这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中会含有少量NaCl.下图为Na2CO3和NaCl的溶解度曲线和部分温度下的溶解度表(单位是克),看图回答下列问题:(1)①t1℃时,NaCl的溶解度
②“冬天捞碱”的原因是由于Na2CO3的溶解度随温度降低而
③“夏天晒盐”是利用
A.利用风吹日晒,使溶剂蒸发 B.升高温度,使NaCl溶解度增大
(2)根据下表分析:
| 温度 物质 |
0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| Na2CO3 | 7.0 | 12.5 | 21.5 | 39.0 | 49.0 |
②下列几种说法中,正确的是
A.碳酸钠晶体的溶解度受温度影响较大
B.将含水各1OOg的氯化钠与碳酸钠的饱和溶液,从30℃降至O℃,析出晶体的质量相等 C.t2对应的温度在2O℃-30℃之间
D.欲从含有少量NaCl杂质的碳酸钠浓溶液中分离出碳酸钠晶体,应采取降低溶液温度的方式. 查看习题详情和答案>>
 我国某地区有一种“冬天捞碱,夏天晒盐”的传统.这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中会含有少量NaCl.下图为Na2CO3和NaCl的溶解度曲线和部分温度下的溶解度表(单位是克),看图回答下列问题:
我国某地区有一种“冬天捞碱,夏天晒盐”的传统.这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中会含有少量NaCl.下图为Na2CO3和NaCl的溶解度曲线和部分温度下的溶解度表(单位是克),看图回答下列问题:
(1)①t1℃时,NaCl的溶解度______ Na2CO3的溶解度.(用“>”“<”或“=”表达)
②“冬天捞碱”的原因是由于Na2CO3的溶解度随温度降低而______(填“增大”“减小”或“不变”).“捞碱”后剩余的溶液一定是Na2CO3的______(填“饱和”或“不饱和”)溶液.
③“夏天晒盐”是利用______(填序号)的方法,使NaCl晶体析出.
A.利用风吹日晒,使溶剂蒸发 B.升高温度,使NaCl溶解度增大
(2)根据下表分析:
| 温度 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| Na2CO3 | 7.0 | 12.5 | 21.5 | 39.0 | 49.0 |
②下列几种说法中,正确的是______.
A.碳酸钠晶体的溶解度受温度影响较大
B.将含水各1OOg的氯化钠与碳酸钠的饱和溶液,从30℃降至O℃,析出晶体的质量相等 C.t2对应的温度在2O℃-30℃之间
D.欲从含有少量NaCl杂质的碳酸钠浓溶液中分离出碳酸钠晶体,应采取降低溶液温度的方式. 查看习题详情和答案>>
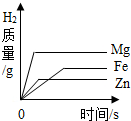
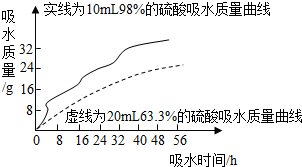
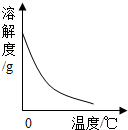
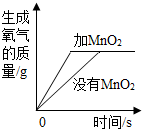
利用曲线图对化学实验中的数据进行分析可以帮助我们对研究对象形成规律化的认识,下列各选项中观察曲线图后得到的结论正确的是( )
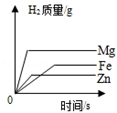 | 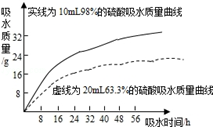 | 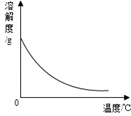 | 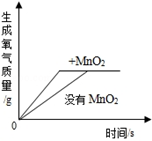 |
| A.等质量的金属与足量的稀硫酸反应:活动性越强的金属生成的氢气就越多 | B.两种溶质质量分数的硫酸吸水性强弱的比较:质量分数越大的硫酸吸收水的质量越多 | C.某物质不同温度下的溶解度:此物质的溶解度随温度升高而减小 | D.二氧化锰对过氧化氢制氧气的影响:加入二氧化锰使H2O2生成氧气的量增多了 |