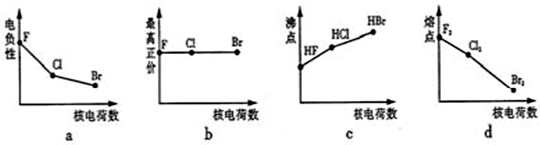
摘要:8.一种元素的原子变成离子.则该原子 ( ) A .一定失去电子 B. 一定得到电子 C可能失去电子或者得到电子 D.既不得到电子,也不失去电子
网址:http://m.1010jiajiao.com/timu3_id_3976596[举报]
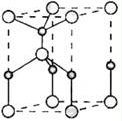
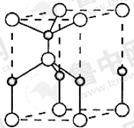
原子序数依次增大的X、Y、Z、Q、E五种元素中,X元素原子核外有三种不同的能级且各个能级所填充的电子数相同,Z是地壳内含量(质量分数)最高的元素,Q原子核外的M层中只有两对成对电子,E元素原子序数为29。请用元素符号或化学式回答下列问题:
(1)X、Y、Z的第一电离能由小到大的顺序为 ;
(2)已知YZ2+与XQ2互为等电子体,则1 mol YZ2+中含有π键数目为_______;
(3)Z的气态氢化物沸点比Q的气态氢化物高的多,其原因是 ;
(4)X、Z与氢元素可形成化合物H2X2Z4,常用作工业除锈剂。H2X2Z4分子中X的杂化方式为 ;
(5)E原子的核外电子排布式为 ;E有可变价态,它的某价态的离子与Z的阴离子形成晶体的晶胞如图所示,该晶体的化学式为 。

查看习题详情和答案>>
原子序数依次增大的A、B、C、D、E、F、G七种短周期主族元素
① B元素的原子最外层电子数是次外层电子数的两倍,
② C的最高价氧化物的水化物和氢化物反应生成盐
③ D和E可以形成1:1和1:2的两种常见化合物。
④ A与C元素原子的电子层数相差1,且与E是同主族元素
⑤ 原子半径由大到小顺序是E>F>G>B>C>D>A
⑥ F是同周期中离子半径最小的元素,G是同周期中原子半径最小的元素
回答:
(1)由B、D、E三元素组成的无机盐水溶液呈碱性,其原因是(用离子方程式表示)_______________________________
(2)A的单质和D的单质可以设计为新型燃料电池,电解质为KOH溶液,则A的单质在该燃料电池中发生的电极反应式为______________________________。
(3)当反应3A2(g)+C2(g) 2CA3(g)达到平衡时,不断改变反应条件(不改变A2、C2和CA3的量),下图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是____________________。
2CA3(g)达到平衡时,不断改变反应条件(不改变A2、C2和CA3的量),下图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是____________________。
① B元素的原子最外层电子数是次外层电子数的两倍,
② C的最高价氧化物的水化物和氢化物反应生成盐
③ D和E可以形成1:1和1:2的两种常见化合物。
④ A与C元素原子的电子层数相差1,且与E是同主族元素
⑤ 原子半径由大到小顺序是E>F>G>B>C>D>A
⑥ F是同周期中离子半径最小的元素,G是同周期中原子半径最小的元素
回答:
(1)由B、D、E三元素组成的无机盐水溶液呈碱性,其原因是(用离子方程式表示)_______________________________
(2)A的单质和D的单质可以设计为新型燃料电池,电解质为KOH溶液,则A的单质在该燃料电池中发生的电极反应式为______________________________。
(3)当反应3A2(g)+C2(g)
 2CA3(g)达到平衡时,不断改变反应条件(不改变A2、C2和CA3的量),下图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是____________________。
2CA3(g)达到平衡时,不断改变反应条件(不改变A2、C2和CA3的量),下图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是____________________。 
(4)D和E能形成1:1和1:2的两种常见化合物X和Y :写出Y与水反应的离子方程式:____________________________。若将X、Y分别溶于等量足量的水中,形成浓度相同的溶液,需X、Y的物质的量的关系为:n(X)________n(Y)(填“<”“>”或“=”)
(5)C、D、E、F、G的简单离子的半径由大到小的顺序是(用元素的离子符号表示)_____________________________
(6)F的最高价氧化物对应水化物的电离方程式为____________________________
(7)用离子方程式说明C与A形成的化合物结合H+能力强于D与A形成的化合物:____________________
查看习题详情和答案>>
(5)C、D、E、F、G的简单离子的半径由大到小的顺序是(用元素的离子符号表示)_____________________________
(6)F的最高价氧化物对应水化物的电离方程式为____________________________
(7)用离子方程式说明C与A形成的化合物结合H+能力强于D与A形成的化合物:____________________
原子序数依次增大的A、B、C、D、E、F、G七种短周期主族元素
①B元素的原子最外层电子数是次外层电子数的两倍,
②C的最高价氧化物的水化物和氢化物反应生成盐
③D和E可以形成1:1和1:2的两种常见化合物。
④A与C元素原子的电子层数相差1,且与E是同主族元素
⑤原子半径由大到小顺序是E>F>G>B>C>D>A
⑥F是同周期中离子半径最小的元素,G是同周期中原子半径最小的元素
回答:
(1)由B、D、E三元素组成的无机盐水溶液呈碱性,其原因是(用离子方程式表示)___________________________________
(2)A的单质和D的单质可以设计为新型燃料电池,电解质为KOH溶液,则A的单质在该燃料电池中发生的电极反应式为__________________________。
(3)当反应3A2(g)+C2(g)
①B元素的原子最外层电子数是次外层电子数的两倍,
②C的最高价氧化物的水化物和氢化物反应生成盐
③D和E可以形成1:1和1:2的两种常见化合物。
④A与C元素原子的电子层数相差1,且与E是同主族元素
⑤原子半径由大到小顺序是E>F>G>B>C>D>A
⑥F是同周期中离子半径最小的元素,G是同周期中原子半径最小的元素
回答:
(1)由B、D、E三元素组成的无机盐水溶液呈碱性,其原因是(用离子方程式表示)___________________________________
(2)A的单质和D的单质可以设计为新型燃料电池,电解质为KOH溶液,则A的单质在该燃料电池中发生的电极反应式为__________________________。
(3)当反应3A2(g)+C2(g)


(4)D和E能形成1:1和1:2的两种常见化合物X和Y :写出Y与水反应的离子方程式:_________________________________。若将X、Y分别溶于等量足量的水中,形成浓度相同的溶液,需X、Y的物质的量的关系为: n(X)____________n(Y)(填“<”“>”或“=”)
(5)C、D、E、F、G的简单离子的半径由大到小的顺序是(用元素的离子符号表示)________________
(6)F的最高价氧化物对应水化物的电离方程式为__________________________
(7)用离子方程式说明C与A形成的化合物结合H+能力强于D与A形成的化合物:___________________
查看习题详情和答案>>
(5)C、D、E、F、G的简单离子的半径由大到小的顺序是(用元素的离子符号表示)________________
(6)F的最高价氧化物对应水化物的电离方程式为__________________________
(7)用离子方程式说明C与A形成的化合物结合H+能力强于D与A形成的化合物:___________________