网址:http://m.1010jiajiao.com/timu3_id_3976565[举报]
短周期元素X、Y、Z、W的原子序数依次增大。X的氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与主族序数相等;Z的单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中。
请回答下列问题:
(1)Y在元素周期表中的位置是________;X的氢化物的电子式是________。
(2)X的氢化物的水溶液与W的氢化物的水溶液混合后恰好反应时,溶液呈________(填“酸”、“碱”或“中”)性,用离子方程式表示其原因:____________________。
(3)Z和W比较,非金属性较弱的是________(填元素符号),下列可以验证这一结论的是________(填序号)。
a.元素在地壳中的含量
b.氧化物对应水化物的酸性
c.断开氢化物中1 mol H—Z或H—W键所需的能量
d.Z与W以共价键形成化合物时,Z或W显示的电性
(4)含Y的两种盐溶液混合产生白色沉淀,写出反应的离子方程式:______________________________________________________。
(5)X、Z、W的最高价氧化物对应的水化物的酸性强弱顺序为________(用化学式表示,下同);Z、W的简单气态氢化物的还原性强弱顺序为________;X、Z、W的最简单氢化物中,沸点最高的是________。
下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
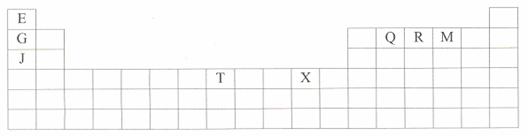
(1)T3+的核外电子排布式是:
(2)Q、R、M的第一电离能由大到小的顺序是 (用元素符号表示)
(3)下列有关上述元素的说法中,正确的是: (填序号)
①G单质的熔点高于J单质,是因为G单质的金属键较强
②J比X活泼,所以J可以在溶液中置换出X
③将J2M2溶于水,要破坏离子键和共价键
④RE3沸点高于QE4,主要是因为前者相对分子质量较大
⑤一个Q2E4分子中含有五个σ键和一个![]() 键
键
(4)加拿大天文台在太空发出了EQ9R,已知分子中所有原子均形成8电子或2电子稳定结构,是直线型分子,不存在配位键。写出其结构式:
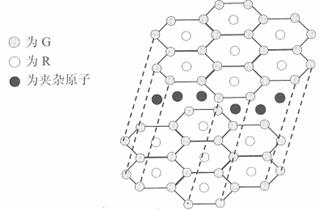
(5)G与R单质直接化合生成一种离子化合物G3R。该晶体具有类似石墨的层状结构。每层中,G原子构成平面六边形,每个六边形的中心有一个R原子。层与层之间还夹杂一定数量的原子。请问这些夹杂的原子应该是 (填G或R的元素符号)
(16分)下表为元素周期表的一部分,请用化学用语回答下列问题:
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | ⑦ | | ⑧ | ⑨ | |
(2)请用化学方程式表示非金属性:②>⑦ _______ ____
(3)表中①、④两种元素的原子可按1:1组成一种具有二元弱酸性质的物质,请写出该物质
的电离方程式: 该弱酸性物质与⑤的最高价氧化物对应的水化物反应时可生成一种酸式盐,该酸式盐的电子式:
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以
 下反应:
下反应: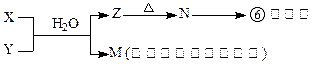
A.X溶液与Y溶液反应的离子方程式为______________ _______,
B.N→⑥的单质的化学方程式为____________ ____。
C.常温下,为了使0.1 mol/L M 溶液中由M电离出的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至_____________ ____。
(5)由④、⑤、⑧三中元素形成的化合物溶液中,加入盐酸发生氧化还原反应的离子方程式是 。 查看习题详情和答案>>
现有部分元素的性质与原子(或分子)结构如下表:
| 元素编号 | 元素性质与原子(或分子)结构 |
| T | 最外层电子数是次外层电子数的3倍 |
| X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
| Y | M层比K层少1个电子 |
| Z | 第3周期元素的简单离子中半径最小 |
(2)元素Y与元素Z相比,金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 (填序号)。
a.Y单质的熔点比Z单质低 b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈 d.Y最高价氧化物的水化物的碱性比Z强
e.Y失去电子的数目比Z少
(3)T、X、Y、Z中有两种元素能形成一种淡黄色的固体,写出该化合物的电子式 ,该物质中含有的化学键是 。
(4)元素T和氢元素以原子个数比1∶1化合形成化合物Q,元素X与氢元素形成的化合物W气态时密度等于氧气,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式 。
(5) X与Z形成的化合物ZX结构类似金刚石,最高可稳定到2200℃,推测属于
晶体。打开盛有ZX的袋口可闻到氨气味,故应避水保存,写出变质反应的化学方程式
。 查看习题详情和答案>>
(10分)下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
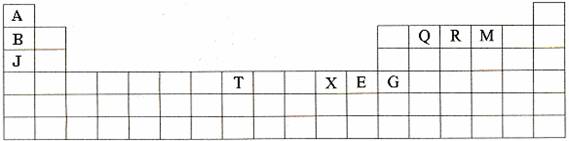
(1)T3+的核外电子排布式是: 。
(2)Q、R、M的第一电离能由大到小的顺序是 (用元素符号表示)。
(3)下列有关上述元素的说法中,正确的是: (填序号)。
①B单质的熔点高于J单质,是因为B单质的金属键较强
②J比X活泼,所以J可以在溶液中置换出X
③将J2M2溶于水,要破坏离子键和共价键
④RA3沸点高于QA4,主要是因为前者相对分子质量较大
⑤一个Q2A4分子中含有五个σ键和一个![]() 键
键
(4)加拿大天文台在太空发现了AQ9R,已知分子中所有原子均形成8电子或2电子稳定结构,是直线型分子,不存在配位键。写出其结构式: 。
(5)B与R单质直接化合生成一种离子化合物B3R。该晶体具有类似石墨的层状结构。每层中,B原子构成平面六边形,每个六边形的中心有一个R原子。层与层之间还夹杂一定数量的原子。请问这些夹杂的原子应该是 (填B或R的元素符号)。
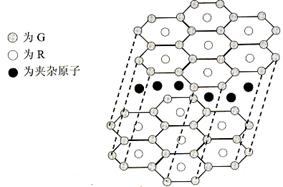
(6)元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。但G的第一电离能却明显低于E,原因是 。
查看习题详情和答案>>