网址:http://m.1010jiajiao.com/timu3_id_3976026[举报]
(1)一氯胺的空间结构为? ?形,电子式为? ?。?
(2)若把氨基换成乙基,则构成的物质A属于? ?类有机物,A在碱性溶液中能发生水解反应的方程式是 。?
(3)若由A通过反应,最终可以制得乙酸乙酯,反应过程可能涉及到的反应类型有 。(用A、 B…表示)?
①取代反应 ②加成反应 ③氧化反应 ④消去反应 ⑤酯化反应?
A.①⑤ B.①③⑤? C.②④⑤ D.①②④?
Ⅱ已知有机物A~F有如下转化关系?

①A的分子式为C10H20O2。②B分子中有两个甲基。?③D、E互为具有相同官能团的同分异构体。D能与碳酸氢钠溶液反应放出CO2,E分子烃基上的氢原子若被Cl取代,其一氯代物有3种。④F可以使溴的四氯化碳溶液褪色,G为高分子化合物。?
(1)B可以发生的反应有? ?(选填序号)。?
①取代反应 ②消去反应 ③加聚反应 ④氧化反应?
(2)D、F分子所含的官能团的名称依次是? ?、? ? 。?
(3)写出与D、E具有相同官能团的同分异构体的可能结构简式: 。?
(4)写出下列转化的化学方程式?
B+E→A ;?
F→G 。?
查看习题详情和答案>>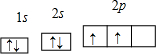

(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子.

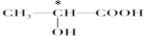
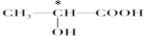
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填序号)
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4
(6)根据价层电子对互斥理论判断下列问题:
H2O中心原子的杂化方式为
BF3分子中,中心原子的杂化方式为
(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于


(2)指出配合物K3[Co(CN)6]中的中心离子、配位体及其配位数:
(3)下列分子中若有手性原子,请用“*”标出其手性碳原子.
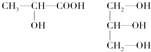
(4)在下列物质①CO2、②NH3、③CCl4、④BF3、⑤H2O、⑥SO2、⑦SO3、⑧PCl3中,属于非极性分子的是(填序号)
(5)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”):H2SO4
(6)根据价层电子对互斥理论判断下列问题:
H2O中心原子的杂化方式为
BF3分子中,中心原子的杂化方式为
(7)H2O的沸点(100℃)比H2S的沸点(-61℃)高,这是由于
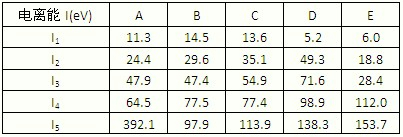
请回答:表中的金属元素是
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,石墨烯的碳源可以由一氧化碳、乙醇、酞菁等中的一种或任意组合提供.
①钴原子在基态时,核外电子排布式为
②乙醇沸点比氯乙烷高,主要原因是
③与CO分子互为等电子体的分子和离子各写出1种,分别为
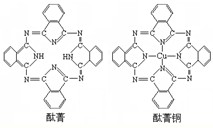
④酞菁与酞菁铜染料分子结构如图,酞菁分子中氮原子采用的杂化方式是
 。在烷烃的取代反应中,伯、仲、叔三种氢原子被取代的几率(机会)不同,但同类氢原子被取代的几率(机会)可视为相同,现将nmol 2-甲基丁烷与适量溴蒸气在一定条件下完全反应,若只生成四种一溴代物和溴化氢。
。在烷烃的取代反应中,伯、仲、叔三种氢原子被取代的几率(机会)不同,但同类氢原子被取代的几率(机会)可视为相同,现将nmol 2-甲基丁烷与适量溴蒸气在一定条件下完全反应,若只生成四种一溴代物和溴化氢。
(1)反应中生成溴化氢的物质的量为________(填代号)
A.![]() mol B.n
mol C.
mol B.n
mol C.![]() mol D.2n mol
mol D.2n mol
(2)将反应生成的四种一溴代物的混合气体充分燃烧,生成H2O、CO2和HBr时需消耗氧气(填代号)。
A.7n mol B.8n mol C.![]() mol D.
mol D.![]() mol
mol
查看习题详情和答案>>