网址:http://m.1010jiajiao.com/timu3_id_39752[举报]
(1)利用反应6NO2+8NH3?7N2+12H2O可处理NO2.当转移3.6mol电子时,生成的N2在标准状况下是
(2)已知:
反应1:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1
反应2:NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ?mol-1
则反应3:2NO(g)+O2(g)?2NO2(g)的△H=
(3)一定条件下,将2molNO与2molO2置于恒容密闭容器中发生上述反应3,下列各项能说明反应达到平衡状态的是
a.体系压强保持不变 b.混合气体颜色保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗1molO2同时生成2molNO2
(4)CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g)?CH3OH(g),达平衡后测得各组分浓度如下:
| 物质 | CO | H2 | CH3OH |
| 浓度(mol?L-1) | 0.9 | 1.0 | 0.6 |
②列式并计算平衡常数K=
③若将容器体积压缩为1L,不经计算,预测新平衡中c(H2)的取值范围是
④若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正
(14分) 研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)利用反应6NO2+8NH3  7N2+12H2O可处理NO2。当转移3.6mol电子时,生成的N2在标准状况下是
L。
7N2+12H2O可处理NO2。当转移3.6mol电子时,生成的N2在标准状况下是
L。
(2)已知:反应1:2SO2(g)+O2(g) 2SO3(g) ΔH = —196.6 kJ·mol-1
2SO3(g) ΔH = —196.6 kJ·mol-1
反应2:NO2(g)+SO2(g) SO3(g)+NO(g) ΔH = —41.8kJ·mol-1
SO3(g)+NO(g) ΔH = —41.8kJ·mol-1
则反3:2NO(g)+O2(g) 2NO2(g)的 ΔH
= _________ kJ·mol-1
2NO2(g)的 ΔH
= _________ kJ·mol-1
(3) 一定条件下,将2molNO与2molO2置于恒容密闭容器中发生上述反应3,下列各项能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.NO和O2的物质的量之比保持不变 d.每消耗1 molO2同时生成2 molNO2
(4)CO可用于合成甲醇,一定温度下,向体积为2L的密闭容器中加入CO和H2,发生反应CO(g)+2H2(g) CH3OH(g),达平衡后测得各组分浓度如下:
CH3OH(g),达平衡后测得各组分浓度如下:
|
物质 |
CO |
H2 |
CH3OH |
|
浓度(mol•L—1) |
0.9 |
1.0 |
0.6 |
①混合气体的平均相对分子质量__________________________。
②列式并计算平衡常数K=__________________________。
③若将容器体积压缩为1L,不经计算,预测新平衡中c(H2)的取值范围是__________。
④若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正___v逆(填“>”、“<”或“=”)。
查看习题详情和答案>>
 CH3OH(g)
CH3OH(g)(1)判断反应达到平衡状态的依据是(填字母序号)__________
| A.生成CH3OH的速率与消耗CO的速率相等 | B.混合气体的密度不变 |
| C.混合气体的相对平均分子质量不变 | D.CH3OH、CO、H2的浓度都不再发生变化 |
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
①该反应化学平衡常数表达式K=
②由表中数据判断该反应的△H__________0(填“>”、“=”或“<”);
③某温度下,将2molCO和6mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得C(CO)=0.2mol·L-1,此时的温度为__________
(3)25℃101KPa下,1g液态甲醇完全燃烧生成CO2和液态水时放出热量22.68kJ,表示甲醇燃烧热的热化学方程式为
(4)据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,该电池工作时负极电极反应式为 。若反应时消耗16g甲醇所产生的电能电解足量的CuSO4溶液,则将产生标准状况下的O2________升
(13分)已知:正盐A强热可得到B、C、D、E四种物质,B通常情况下为无色无味液体,E、F 是空气主要成分,D能产生酸雨,I为红棕色气体,C与J反应可得A,J、K为两种常见的酸。物质之间的转化关系如图所示(图中部分反应物或生成物及反应条件未列出)。 
请回答下列问题:
(1)E物质的电子式是________。
(2)检验C的试纸是________,检验D的试剂是________(填试纸、试剂名称)。
(3)写出A强热分解生成B、C、D、E的化学方程式________。
(4)写出D通人FeCl3溶液时,发生反应的离子方程式_____ 。
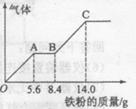
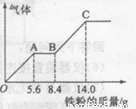
(5) —定浓度J、K混合后的稀溶液200mL,平均分成两份。向其中一份中逐渐加人铜粉,最多能溶解a g(产生气体只为G)。向另一份中逐渐加人铁粉,产生气体的量随铁粉质量增加的变化如图所示。则①a=________g,②气体G标准状况下体积为________,③J的物质的量浓度为______。
查看习题详情和答案>>
(13分)已知:正盐A强热可得到B、C、D、E四种物质,B通常情况下为无色无味液体,E、F 是空气主要成分,D能产生酸雨,I为红棕色气体,C与J反应可得A,J、K为两种常见的酸。物质之间的转化关系如图所示(图中部分反应物或生成物及反应条件未列出)。 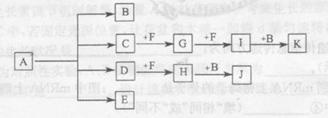
请回答下列问题:
(1)E物质的电子式是________。
(2)检验C的试纸是________,检验D的试剂是________(填试纸、试剂名称)。
(3)写出A强热分解生成B、C、D、E的化学方程式________。
(4)写出D通人FeCl3溶液时,发生反应的离子方程式_____ 。
(5) —定浓度J、K混合后的稀溶液200mL,平均分成两份。向其中一份中逐渐加人铜粉,最多能溶解a g(产生气体只为G)。向另一份中逐渐加人铁粉,产生气体的量随铁粉质量增加的变化如图所示。则①a=________g,②气体G标准状况下体积为________,③J的物质的量浓度为______。