摘要:下列操作不能加快溶解速度的是 ( ) A.振荡 B. 搅拌 C. 加热 D. 过滤
网址:http://m.1010jiajiao.com/timu3_id_3974922[举报]
某化学课外活动小组在实验室做了如下一系列实验:
该小组设计了如图1所示的一套气体发生、收集和尾气吸收装置以探究装置的多功能性.
①甲同学认为装置Ⅰ可作为实验室制氧气的快速发生器,则装置Ⅰ的a仪器中可加入
②乙同学认为利用装置Ⅱ,可收集NO,试简述操作方法
(一)定性检验
(1)往黑色粉末中滴加盐酸,观察到有气泡产生,则黑色粉末中一定有
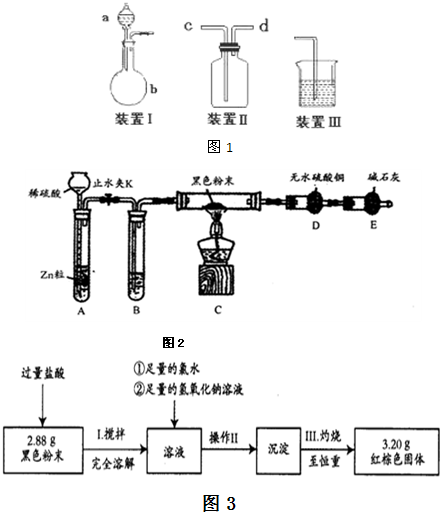
(2)热还原法检验:按图2装置连接好仪器(图中夹持设备已略去),检查装置的气密性.往装置中添加药品.打开止水夹K通入氢气,持续一段时间后再点燃C处的酒精灯.
请回答下列问题:
①检查装置A气密性的方法是
②B中试剂的名称是_
③若加热一段时间后,装置D中白色粉末变蓝色,对黑色粉末的组成得出的结论是
④综上所述:黑色粉末的组成为
(3)为进一步证明黑色粉末是否含Fe3O4,某同学设计实验方案如下:取少量黑色粉末于试管,加足量盐酸,充分振荡使黑色粉末完全溶解,滴入KSCN溶液,观察现象.请分析此方案是否可行,并解释原因.答:
(二).沉淀法定量测定
为进一步分析该黑色粉中两组分的比例关系,按图3实验流程进行测定.
(4)操作II的名称是
(5)通过以上数据,计算黑色粉末中两组分的质量分别为
查看习题详情和答案>>

该小组设计了如图1所示的一套气体发生、收集和尾气吸收装置以探究装置的多功能性.
①甲同学认为装置Ⅰ可作为实验室制氧气的快速发生器,则装置Ⅰ的a仪器中可加入
H2O2
H2O2
或H2O
H2O
,装置Ⅱ从C
C
管口进气即可作为排气法收集O2的装置.②乙同学认为利用装置Ⅱ,可收集NO,试简述操作方法
先往集气瓶中装满水,按照图Ⅱ装置好,C导气管接装置Ⅲ后,从D处导气管通入一氧化氮气体排净集气瓶内的水
先往集气瓶中装满水,按照图Ⅱ装置好,C导气管接装置Ⅲ后,从D处导气管通入一氧化氮气体排净集气瓶内的水
学习小组在研究CH4还原Fe2O3的实验中,发现生成的黑色粉末各组分均能被磁铁吸引.查阅资料得知:在温度不同、受热不均时会生成具有磁性的Fe3O4.为进一步探究黑色粉末的组成及含量,他们进行如下实验.(一)定性检验
(1)往黑色粉末中滴加盐酸,观察到有气泡产生,则黑色粉末中一定有
Fe
Fe
,产生气泡的离子方程式为Fe+2H+=Fe2++H2↑
Fe+2H+=Fe2++H2↑
.(2)热还原法检验:按图2装置连接好仪器(图中夹持设备已略去),检查装置的气密性.往装置中添加药品.打开止水夹K通入氢气,持续一段时间后再点燃C处的酒精灯.
请回答下列问题:
①检查装置A气密性的方法是
关闭止水夹K,往长颈漏斗加水至漏斗内的液面高于导气管,静置一段时间后液面差保持不变,说明装置A的气密性良好
关闭止水夹K,往长颈漏斗加水至漏斗内的液面高于导气管,静置一段时间后液面差保持不变,说明装置A的气密性良好
.②B中试剂的名称是_
浓硫酸
浓硫酸
.③若加热一段时间后,装置D中白色粉末变蓝色,对黑色粉末的组成得出的结论是
是
是
(填“是或否”)含有Fe3O4.④综上所述:黑色粉末的组成为
Fe
Fe
和Fe3O4
Fe3O4
.(3)为进一步证明黑色粉末是否含Fe3O4,某同学设计实验方案如下:取少量黑色粉末于试管,加足量盐酸,充分振荡使黑色粉末完全溶解,滴入KSCN溶液,观察现象.请分析此方案是否可行,并解释原因.答:
不可行,因Fe3O4溶于盐酸生成Fe3+与Fe反应生成Fe2+,溶液不变色
不可行,因Fe3O4溶于盐酸生成Fe3+与Fe反应生成Fe2+,溶液不变色
.(二).沉淀法定量测定
为进一步分析该黑色粉中两组分的比例关系,按图3实验流程进行测定.
(4)操作II的名称是
过滤
过滤
、洗涤
洗涤
、转移固体.(5)通过以上数据,计算黑色粉末中两组分的质量分别为
Fe 0.56 Fe3O4 2.32
Fe 0.56 Fe3O4 2.32
.某化学课外活动小组在实验室做了如下一系列实验: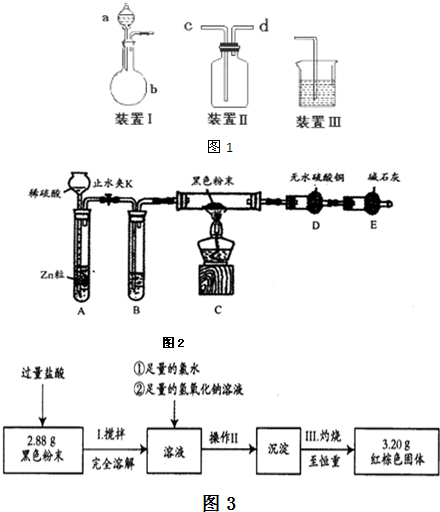
该小组设计了如图1所示的一套气体发生、收集和尾气吸收装置以探究装置的多功能性.
①甲同学认为装置Ⅰ可作为实验室制氧气的快速发生器,则装置Ⅰ的a仪器中可加入______或______,装置Ⅱ从______管口进气即可作为排气法收集O2的装置.
②乙同学认为利用装置Ⅱ,可收集NO,试简述操作方法______..学习小组在研究CH4还原Fe2O3的实验中,发现生成的黑色粉末各组分均能被磁铁吸引.查阅资料得知:在温度不同、受热不均时会生成具有磁性的Fe3O4.为进一步探究黑色粉末的组成及含量,他们进行如下实验.
(一)定性检验
(1)往黑色粉末中滴加盐酸,观察到有气泡产生,则黑色粉末中一定有______,产生气泡的离子方程式为______.
(2)热还原法检验:按图2装置连接好仪器(图中夹持设备已略去),检查装置的气密性.往装置中添加药品.打开止水夹K通人氢气,持续一段时间后再点燃C处的酒精灯.
请回答下列问题:
①检查装置A气密性的方法是______.
②B中试剂的名称是_______.
③若加热一段时间后,装置D中白色粉末变蓝色,对黑色粉末的组成得出的结论是______ (填“是或否”)含有Fe3O4.
④综上所述:黑色粉末的组成为______和______.
(3)为进一步证明黑色粉末是否含Fe3O4,某同学设计实验方案如下:取少量黑色粉末于试管,加足量盐酸,充分振荡使黑色粉末完全溶解,滴人KSCN溶液,观察现象.请分析此方案是否可行,并解释原因.答:______.
(二).沉淀法定量测定
为进一步分析该黑色粉中两组分的比例关系,按图3实验流程进行测定.
(4)操作II的名称是______、______、转移固体.
(5)通过以上数据,计算黑色粉末中两组分的质量分别为______.
查看习题详情和答案>>
某化学课外活动小组在实验室做了如下一系列实验:
该小组设计了如图1所示的一套气体发生、收集和尾气吸收装置以探究装置的多功能性.
①甲同学认为装置Ⅰ可作为实验室制氧气的快速发生器,则装置Ⅰ的a仪器中可加入______或______,装置Ⅱ从______管口进气即可作为排气法收集O2的装置.
②乙同学认为利用装置Ⅱ,可收集NO,试简述操作方法______..学习小组在研究CH4还原Fe2O3的实验中,发现生成的黑色粉末各组分均能被磁铁吸引.查阅资料得知:在温度不同、受热不均时会生成具有磁性的Fe3O4.为进一步探究黑色粉末的组成及含量,他们进行如下实验.
(一)定性检验
(1)往黑色粉末中滴加盐酸,观察到有气泡产生,则黑色粉末中一定有______,产生气泡的离子方程式为______.
(2)热还原法检验:按图2装置连接好仪器(图中夹持设备已略去),检查装置的气密性.往装置中添加药品.打开止水夹K通人氢气,持续一段时间后再点燃C处的酒精灯.
请回答下列问题:
①检查装置A气密性的方法是______.
②B中试剂的名称是_______.
③若加热一段时间后,装置D中白色粉末变蓝色,对黑色粉末的组成得出的结论是______ (填“是或否”)含有Fe3O4.
④综上所述:黑色粉末的组成为______和______.
(3)为进一步证明黑色粉末是否含Fe3O4,某同学设计实验方案如下:取少量黑色粉末于试管,加足量盐酸,充分振荡使黑色粉末完全溶解,滴人KSCN溶液,观察现象.请分析此方案是否可行,并解释原因.答:______.
(二).沉淀法定量测定
为进一步分析该黑色粉中两组分的比例关系,按图3实验流程进行测定.
(4)操作II的名称是______、______、转移固体.
(5)通过以上数据,计算黑色粉末中两组分的质量分别为______.
查看习题详情和答案>>

该小组设计了如图1所示的一套气体发生、收集和尾气吸收装置以探究装置的多功能性.
①甲同学认为装置Ⅰ可作为实验室制氧气的快速发生器,则装置Ⅰ的a仪器中可加入______或______,装置Ⅱ从______管口进气即可作为排气法收集O2的装置.
②乙同学认为利用装置Ⅱ,可收集NO,试简述操作方法______..学习小组在研究CH4还原Fe2O3的实验中,发现生成的黑色粉末各组分均能被磁铁吸引.查阅资料得知:在温度不同、受热不均时会生成具有磁性的Fe3O4.为进一步探究黑色粉末的组成及含量,他们进行如下实验.
(一)定性检验
(1)往黑色粉末中滴加盐酸,观察到有气泡产生,则黑色粉末中一定有______,产生气泡的离子方程式为______.
(2)热还原法检验:按图2装置连接好仪器(图中夹持设备已略去),检查装置的气密性.往装置中添加药品.打开止水夹K通人氢气,持续一段时间后再点燃C处的酒精灯.
请回答下列问题:
①检查装置A气密性的方法是______.
②B中试剂的名称是_______.
③若加热一段时间后,装置D中白色粉末变蓝色,对黑色粉末的组成得出的结论是______ (填“是或否”)含有Fe3O4.
④综上所述:黑色粉末的组成为______和______.
(3)为进一步证明黑色粉末是否含Fe3O4,某同学设计实验方案如下:取少量黑色粉末于试管,加足量盐酸,充分振荡使黑色粉末完全溶解,滴人KSCN溶液,观察现象.请分析此方案是否可行,并解释原因.答:______.
(二).沉淀法定量测定
为进一步分析该黑色粉中两组分的比例关系,按图3实验流程进行测定.
(4)操作II的名称是______、______、转移固体.
(5)通过以上数据,计算黑色粉末中两组分的质量分别为______.
某化学课外活动小组在实验室做了如下一系列实验: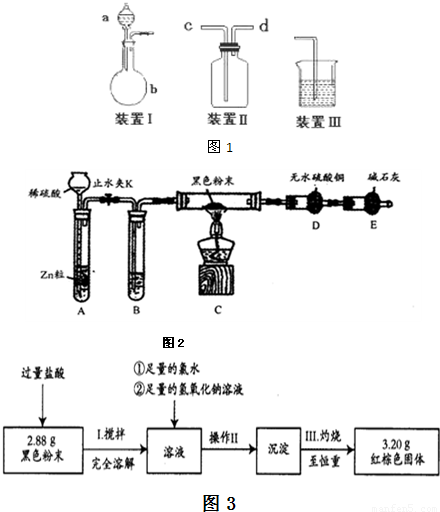
该小组设计了如图1所示的一套气体发生、收集和尾气吸收装置以探究装置的多功能性.
①甲同学认为装置Ⅰ可作为实验室制氧气的快速发生器,则装置Ⅰ的a仪器中可加入______或______,装置Ⅱ从______管口进气即可作为排气法收集O2的装置.
②乙同学认为利用装置Ⅱ,可收集NO,试简述操作方法______..学习小组在研究CH4还原Fe2O3的实验中,发现生成的黑色粉末各组分均能被磁铁吸引.查阅资料得知:在温度不同、受热不均时会生成具有磁性的Fe3O4.为进一步探究黑色粉末的组成及含量,他们进行如下实验.
(一)定性检验
(1)往黑色粉末中滴加盐酸,观察到有气泡产生,则黑色粉末中一定有______,产生气泡的离子方程式为______.
(2)热还原法检验:按图2装置连接好仪器(图中夹持设备已略去),检查装置的气密性.往装置中添加药品.打开止水夹K通入氢气,持续一段时间后再点燃C处的酒精灯.
请回答下列问题:
①检查装置A气密性的方法是______.
②B中试剂的名称是_______.
③若加热一段时间后,装置D中白色粉末变蓝色,对黑色粉末的组成得出的结论是______ (填“是或否”)含有Fe3O4.
④综上所述:黑色粉末的组成为______和______.
(3)为进一步证明黑色粉末是否含Fe3O4,某同学设计实验方案如下:取少量黑色粉末于试管,加足量盐酸,充分振荡使黑色粉末完全溶解,滴入KSCN溶液,观察现象.请分析此方案是否可行,并解释原因.答:______.
(二).沉淀法定量测定
为进一步分析该黑色粉中两组分的比例关系,按图3实验流程进行测定.
(4)操作II的名称是______、______、转移固体.
(5)通过以上数据,计算黑色粉末中两组分的质量分别为______.
查看习题详情和答案>>

该小组设计了如图1所示的一套气体发生、收集和尾气吸收装置以探究装置的多功能性.
①甲同学认为装置Ⅰ可作为实验室制氧气的快速发生器,则装置Ⅰ的a仪器中可加入______或______,装置Ⅱ从______管口进气即可作为排气法收集O2的装置.
②乙同学认为利用装置Ⅱ,可收集NO,试简述操作方法______..学习小组在研究CH4还原Fe2O3的实验中,发现生成的黑色粉末各组分均能被磁铁吸引.查阅资料得知:在温度不同、受热不均时会生成具有磁性的Fe3O4.为进一步探究黑色粉末的组成及含量,他们进行如下实验.
(一)定性检验
(1)往黑色粉末中滴加盐酸,观察到有气泡产生,则黑色粉末中一定有______,产生气泡的离子方程式为______.
(2)热还原法检验:按图2装置连接好仪器(图中夹持设备已略去),检查装置的气密性.往装置中添加药品.打开止水夹K通入氢气,持续一段时间后再点燃C处的酒精灯.
请回答下列问题:
①检查装置A气密性的方法是______.
②B中试剂的名称是_______.
③若加热一段时间后,装置D中白色粉末变蓝色,对黑色粉末的组成得出的结论是______ (填“是或否”)含有Fe3O4.
④综上所述:黑色粉末的组成为______和______.
(3)为进一步证明黑色粉末是否含Fe3O4,某同学设计实验方案如下:取少量黑色粉末于试管,加足量盐酸,充分振荡使黑色粉末完全溶解,滴入KSCN溶液,观察现象.请分析此方案是否可行,并解释原因.答:______.
(二).沉淀法定量测定
为进一步分析该黑色粉中两组分的比例关系,按图3实验流程进行测定.
(4)操作II的名称是______、______、转移固体.
(5)通过以上数据,计算黑色粉末中两组分的质量分别为______.
查看习题详情和答案>>
化学是以实验为基础的学科,化学实验又有定性实验和定量实验之分.利用已学知识对下列实验进行分析并填空:
Ⅰ.
Ⅱ.
Ⅲ.
资料:氯气难溶于饱和氯化钠溶液;实验室可利用MnO2和浓盐酸在加热的条件下制备氯气
实验:某食盐样品中混有NaBr杂质,为测定该食盐样品的纯度,设计实验过程如甲图所示:

阅读上述资料和实验过程,完成下列填空:
(1)请从乙图中选出四个装置(可重复使用),来完成制取并向溶液A中通入过量Cl2的实验,将所选装置的选项代码填入方框,并在括号中写出装置内所放的化学药品.

(2)为了证明甲图中溶液D中几乎不存在Br-,可选用的试剂为
A.碘水
B.淀粉碘化钾溶液
C.新制氯水和四氯化碳
D.食盐水
(3)依据甲图所示,在萃取操作中应选取的有机溶剂为
A.四氯化碳 B.水 C.乙醇 D.苯
(4)在萃取、分液的过程中,把分液漏斗玻璃塞上的凹槽对准漏斗口上的小孔,其目的是
(5)试计算原固体混合物中氯化钠的质量分数为
查看习题详情和答案>>
Ⅰ.
| 实验目的 | 探究温度对H2O2分解反应速率的影响 探究温度对H2O2分解反应速率的影响 | ||||||||||
实验 |
 |
 |
 | ||||||||
| 实验结论 | 结论: 温度越高,反应速率越快 温度越高,反应速率越快 FeCl3在实验中的作用为: 催化剂 催化剂 | ||||||||||
| 反应方程式 | 2H2O2
2H2O2
| ||||||||||
| 实验目的 | 探究卤素单质氧化性的相对强弱 | |
| 实验 | 现象 | 离子方程式 |
| 1.将少量氯水分别加入盛有KBr和NaI溶液的试管中, 振荡后加入CCl4,振荡、静置 |
(1)溶液分层,上层几 乎无色,下层为橙色. (2) 溶液分层,上层几乎无色,下层为紫(红)色 溶液分层,上层几乎无色,下层为紫(红)色 |
(1) Cl2+2Br-=Br2+2Cl- Cl2+2Br-=Br2+2Cl- (2) Cl2+2I-=I2+2Cl- Cl2+2I-=I2+2Cl- |
| 2.将少量溴水加入盛有NaI溶液的试管中, 振荡后加入少量CCl4,振荡、静置 |
/ | (3) Br2+2I-=I2+2Br- Br2+2I-=I2+2Br- |
| 实验结论并从原子结构上解释原因 | 结论:氧化性:Cl2>Br2>I2 解释原因:同主族元素从上到下,核电荷数逐渐增大,电子层数逐渐增多,原子半径逐渐增大,原子核对外层电子的引力逐渐减弱,单质的氧化性逐渐减弱 结论:氧化性:Cl2>Br2>I2 解释原因:同主族元素从上到下,核电荷数逐渐增大,电子层数逐渐增多,原子半径逐渐增大,原子核对外层电子的引力逐渐减弱,单质的氧化性逐渐减弱 | |
资料:氯气难溶于饱和氯化钠溶液;实验室可利用MnO2和浓盐酸在加热的条件下制备氯气
实验:某食盐样品中混有NaBr杂质,为测定该食盐样品的纯度,设计实验过程如甲图所示:

阅读上述资料和实验过程,完成下列填空:
(1)请从乙图中选出四个装置(可重复使用),来完成制取并向溶液A中通入过量Cl2的实验,将所选装置的选项代码填入方框,并在括号中写出装置内所放的化学药品.

(2)为了证明甲图中溶液D中几乎不存在Br-,可选用的试剂为
C
C
(填选项字母).A.碘水
B.淀粉碘化钾溶液
C.新制氯水和四氯化碳
D.食盐水
(3)依据甲图所示,在萃取操作中应选取的有机溶剂为
D
D
.A.四氯化碳 B.水 C.乙醇 D.苯
(4)在萃取、分液的过程中,把分液漏斗玻璃塞上的凹槽对准漏斗口上的小孔,其目的是
内外气压相通,使分液漏斗内液体能够顺利流下
内外气压相通,使分液漏斗内液体能够顺利流下
.(5)试计算原固体混合物中氯化钠的质量分数为
90
90
%.