摘要:12.已知:2 H2(g) + O2(g) = 2 H2O(g) △H1, 2 H2(g) + O2(g) = 2 H2O(l) △H2, 2 CO(g) + O2(g) = 2 CO2(g) △H3. ⑴ 写出液态水转化为气态水的热化学方程式 . ⑵ CO和H 2分别燃烧生成CO2(g)和H 2O(g).欲得到相同热量.所需CO和H 2的体积比是 . 答案: ⑴ H2O(l) = H2O(g), ⑵ 解析:⑴ 2 H2(g) + O2(g) = 2 H2O(l)可以看作由以下两个过程组成: 2 H2(g) + O2(g) = 2 H2O(g) △H1, H2O(l) = H2O(g) (焓变设为△Hx), 根据“盖斯定律 . △H2 = △H1 +△Hx .△Hx = . ⑵根据2 H2(g) + O2(g ) = 2 H2O (g) (△H1), 2 CO(g) + O2(g) = 2 CO2(g) (△H3)可知:欲得到相同热量.所需CO和H 2的物质的量之比等于.同温同压下,二者体积比等于物质的量之比.等于. 评价:此题旨在考查“盖斯定律 的运用和有关“燃烧热 的计算.属于中等难度题.
网址:http://m.1010jiajiao.com/timu3_id_39725[举报]
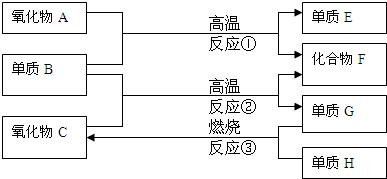
(11分)(1)在实验室里可以用浓盐酸跟二氧化锰起反应制取氯气,反应的化学方程式为:______________________________________________________。
(2)往过氧化氢溶液中加入二氧化锰粉末可以产生氧气,此反应中二氧化锰的作用是_____________。
(3)在SO2、CaO、D2、HCl、Na2CO3五种纯物质中,属于共价化合物的是_________________________;含非极性键的是_______________。
(4)已知:2 SO2 + O2 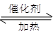 2 SO3 。向一密闭容器中充入SO2 与18O2
,反应一段时间后,含18O的物质是_______________________。
2 SO3 。向一密闭容器中充入SO2 与18O2
,反应一段时间后,含18O的物质是_______________________。
(5)如下反应:
① Zn + CuSO4 = ZnSO4 +Cu ② NaOH + HCl = NaCl + H2O
③ 4Al + 3O2 = 2Al2O3 ④ Na2CO3 + H2SO4 = Na2SO4 + CO2↑+ H2O
其中可以设计成原电池的是_______________(写序号)。
查看习题详情和答案>>
已知反应:2H2+O2=2H2O+能量,请填写下列表格中空白处的总能量值,并注明消耗还是放出.有关键能:H-H:436kJ/mol O=O:496kJ/mol H-O:463kJ/mol
查看习题详情和答案>>
| 拆开化学键 | 形成化学键 | 能量变化 |
| 2mol H2中的化学键 | 4mol H-O键 | 4×463kJ-2×436kJ-496kJ=484kJ |
| 1mol O2中的化学键 | ||
共消耗1368 kJ 共消耗1368 kJ |
共释放1852 kJ 共释放1852 kJ |
放热484 kJ 放热484 kJ |
已知:2SO2(g)+O2(g)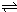 2SO3(g)△H=-196.6kJ?mol-1
2SO3(g)△H=-196.6kJ?mol-1
2NO(g)+O2(g)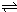 2NO2(g)△H=-113.0kJ?mol-1
2NO2(g)△H=-113.0kJ?mol-1
写出NO2(g)与SO2(g)生成SO3(g)和NO(g)热化学方程式
(2)已知N2与H2反应生成NH3的能量变化如图所示: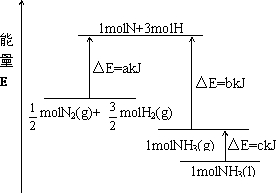
则
N2(g)+
H2(g)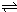 NH3(l);△H=
NH3(l);△H=
查看习题详情和答案>>
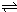 2SO3(g)△H=-196.6kJ?mol-1
2SO3(g)△H=-196.6kJ?mol-12NO(g)+O2(g)
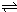 2NO2(g)△H=-113.0kJ?mol-1
2NO2(g)△H=-113.0kJ?mol-1写出NO2(g)与SO2(g)生成SO3(g)和NO(g)热化学方程式
NO2(g)+SO2(g)═SO3(g)+NO(g)△H=-41.8kJ?mol-1
NO2(g)+SO2(g)═SO3(g)+NO(g)△H=-41.8kJ?mol-1
.(2)已知N2与H2反应生成NH3的能量变化如图所示:

则
| 1 |
| 2 |
| 3 |
| 2 |
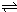 NH3(l);△H=
NH3(l);△H=(a-b-c)kJ?mol-1
(a-b-c)kJ?mol-1
.(2010?南宁一模)(1)已知pH=2的高碘酸(H5IO6)溶液与Ph=12的NaOH溶液等体积混合,所得混台液显酸性;则高碘酸是
已知0.01mol?L-1的碘酸( HIO6))或高锰酸(HMnO4)溶液与pH=12的NaOH溶液等体积混合,所得混合液显中性,且知高碘酸和硫酸锰( MnSO4)在溶液中反应生成高锰酸、碘酸和硫酸,则此反应的离子方程式是
(2)体积不变的密闭容器内部有一不漏气且可滑动的话塞将容器分成左右两个室,左室内充入一定体积的CO和H2O气体,右室充入SO2和O2两种气体共4mol,且SO2和O2的物质的量之比为2:1,左右两室内各可发生如下反应:
左室 CO(g)+H2O(G)?CO2(g)+H2(g);△H<0
右室 2SO2(g)+O2(g)?2SO3(g);△H<0

反应开始时活塞停留在离左端点
处,反应在恒温下进行,当达平衡状态时,活塞处于容器中间.反应达平衡时,生成SO3
查看习题详情和答案>>
弱酸
弱酸
(填“强酸”或“弱酸”),理由是:由于高碘酸溶液的c(H+)与NaOH溶液的c(OH-)相等,二者等体积混合后,混合液显酸性,说明酸过量,原高碘酸溶液中只有一部分高碘酸的分子发生了电离,所以高碘酸是弱酸
由于高碘酸溶液的c(H+)与NaOH溶液的c(OH-)相等,二者等体积混合后,混合液显酸性,说明酸过量,原高碘酸溶液中只有一部分高碘酸的分子发生了电离,所以高碘酸是弱酸
.已知0.01mol?L-1的碘酸( HIO6))或高锰酸(HMnO4)溶液与pH=12的NaOH溶液等体积混合,所得混合液显中性,且知高碘酸和硫酸锰( MnSO4)在溶液中反应生成高锰酸、碘酸和硫酸,则此反应的离子方程式是
5H5IO6+2Mn2+=11H++MnO4-+5IO3-+7H2O
5H5IO6+2Mn2+=11H++MnO4-+5IO3-+7H2O
.(2)体积不变的密闭容器内部有一不漏气且可滑动的话塞将容器分成左右两个室,左室内充入一定体积的CO和H2O气体,右室充入SO2和O2两种气体共4mol,且SO2和O2的物质的量之比为2:1,左右两室内各可发生如下反应:
左室 CO(g)+H2O(G)?CO2(g)+H2(g);△H<0
右室 2SO2(g)+O2(g)?2SO3(g);△H<0

反应开始时活塞停留在离左端点
| 3 | 7 |
2
2
mol,此时若再向左室中充入与原物质的量之比相同的CO和H2O气体,则达到新平衡时CO的物质的量分数不变
不变
,SO2的物质的量分数减小
减小
.(填“不变”或“变小”或“变大”)