摘要:同种元素的原子都具有相同的( ) A.核电荷数 B.中子数 C.质子数和中子数 D.电子数
网址:http://m.1010jiajiao.com/timu3_id_3971858[举报]
A、B、C、D、E都为短周期元素,A是相对原子质量最小的元素;B的+1价阳离子和C的-1价阴离子都与氖原子具有相同的电子层结构;D在C的下一周期,可与B形成BD型离子化合物;E和C为同一周期元素,其最高价氧化物对应的水化物为一种强酸.请根据以上信息回答下列问题.
(1)B元素在元素周期表中的位置是第
(2)画出D元素的原子结构示意图
 .
.
(3)与E的氢化物分子所含电子总数相等的分子是
(4)A与C形成的化合物中含有化学键的类型是
(5)D的单质与B的最高价氧化物对应的水化物的溶液发生反应的离子方程式为
查看习题详情和答案>>
(1)B元素在元素周期表中的位置是第
三
三
周期IA
IA
族.(2)画出D元素的原子结构示意图


(3)与E的氢化物分子所含电子总数相等的分子是
H2O
H2O
(举一例、填化学式,下同)、离子是OH-
OH-
.(4)A与C形成的化合物中含有化学键的类型是
共价键
共价键
.(5)D的单质与B的最高价氧化物对应的水化物的溶液发生反应的离子方程式为
Cl2+2OH-=ClO-+Cl-+H2O
Cl2+2OH-=ClO-+Cl-+H2O
.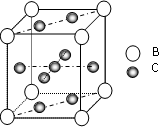 A、B、C、D、E、F 是第四周期的元素其单质均为固体,其相关的性质如下:
A、B、C、D、E、F 是第四周期的元素其单质均为固体,其相关的性质如下:(1)A、B原子处于基态时,原子核外电子均成对,且核电荷数A>B 写出A的基态外围电子轨道表示式


(2)C与A在周期表同属于一个区的元素,写C2+的核外电子排布式
[Ar]3d9
[Ar]3d9
.(3)图是金属B和C所形成的某种合金的晶胞结构示意图,用最简式表示该合金中的组成
CaCu5
CaCu5
.(用B、C元素符号表示)(4)C2+和A2+都能与NH3、H2O、Cl-等形成配位数为4的配合物.[A(NH3)4]2+和[C (NH3)4]2+都具有对称的空间构型,[C(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,而[A(NH3)4]2+中的两个NH3被两个Cl-取代,只能得到一种产物,则[C(NH3)4]2+的空间构型为
平面正方形
平面正方形
.[A(NH3)4]2+A原子轨道的杂化方式为sp3
sp3
.(5)D、E、F均位于P区,电负性D<E<F,第一电离能D<F<E,D只有一个未成对电子.D在元素周期表中有位置是
第四周期第IIIA族
第四周期第IIIA族
,D、E形成化合物的化学式GaAs
GaAs
,该化合物的一种用途是半导体材料
半导体材料
F的最高价氧化物对水化物的分子式为H2SeO4
H2SeO4
.A、B、C、D都是短周期中的元素,A元素的离子焰色反应呈黄色;B原子核内质子数和中子数相等,B元素的离子和Ne具有相同的电子层结构;2.4g B单质恰好与100ml 2mol/L的盐酸完全反应;H2在C单质中燃烧产生苍白火焰;D元素原子的最外层电子数是次外层电子数的3倍.根据上述条件,回答:
(1)A是
 .
.
(2)元素C位于第
(3)A与D的单质在加热条件下形成化合物的化学式为
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为
查看习题详情和答案>>
(1)A是
Na
Na
元素,B是Mg
Mg
元素,D是O
O
元素.四种元素中金属性最强的是Na
Na
(填写元素符号),B和D形成的化合物的电子式为

(2)元素C位于第
三
三
周期ⅤⅡA
ⅤⅡA
族,它的最高价氧化物对应水化物的化学式为HClO4
HClO4
.(3)A与D的单质在加热条件下形成化合物的化学式为
Na2O2
Na2O2
该化合物中含有的化学键类型为离子键、非极性共价键
离子键、非极性共价键
(填“离子键”“极性共价键”或“非极性共价键”).(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为
Cl2 +2OH-=Cl-+ClO-+H2O
Cl2 +2OH-=Cl-+ClO-+H2O
.A、B、C、D都是周期表中前20号元素,已知A的阳离子和C的阴离子具有相同的核外电子排布,且能形成组成为AC的化合物;C和D属同主族,其中C的核外电子数是D的核内质子数的2倍.B和D是同周期元素且A和B能形成AB2型化合物.下列说法中正确的是( )
查看习题详情和答案>>
A、B、C、D四种元素都是短周期元素.A元素的离子具有黄色的焰色反应.B元素的离子结构和Ne具有相同的电子层排布;5.8gB的氢氧化物恰好能与100mL2mol/L盐酸完全反应;B原子核中质子数和中子数相等.H2在C单质中燃烧产生苍白色火焰.D元素原子的电子层结构里,最外层电子数是次外层电子数的3倍.根据上述条件,回答:
(1)元素C位于第
(2)A是
(3)A与D形成稳定的化合物的化学式为
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为
查看习题详情和答案>>
(1)元素C位于第
三
三
周期ⅤⅡA
ⅤⅡA
族,它的最高价氧化物的化学式为Cl2O7
Cl2O7
.(2)A是
Na
Na
元素,B是Mg
Mg
元素,D是O
O
元素.(3)A与D形成稳定的化合物的化学式为
Na2O2
Na2O2
,判断该化合物在空气中是否变质的简单方法是观察是否变白
观察是否变白
.(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为
Cl2 +2OH-=Cl-+ClO-+H2O
Cl2 +2OH-=Cl-+ClO-+H2O
.