摘要:26.位于元素周期表第三.四两周期中的主族元素A和B.它们的离子相差两个电子层.已知A元素位于元素周期表中第m主族.B元素位于第n主族.那么: (1)A元素原子的核外电子数为 .其离子最外层电子数为 , (2)B元素原子的核内质子数为 .其离子的电子数为 , (3)A.B两元素形成的化合物的化学式为AB2.其化学键类型为 , (4)用电子式表示AB2为 .
网址:http://m.1010jiajiao.com/timu3_id_397106[举报]
分别位于元素周期表中第三、四两周期中的主族元素A和B,它们的离子相差两个电子层。已知A元素位于周期表中第m主族,B元素位于第n主族。那么:
①A元素的原子序数为________(用m表示),其离子核外有个电子。
②B元素的原子序数为________(用n表示),其离子核外有个电子。
③若A、B形成的化合物为A2B,则A2B的电子式为________,指出B元素在周期中的位置________④若A、B两元素形成化合物AB2,则B的气态氢化物的电子式为________。
查看习题详情和答案>>
分别位于元素周期表中第三、四两周期中的主族元素A和B,它们的离子相差两个电子层。已知A元素位于周期表中第m主族,B元素位于第n主族。那么:
①A元素的原子序数为________(用m表示),其离子核外有个电子。
②B元素的原子序数为________(用n表示),其离子核外有个电子。
③若A、B形成的化合物为A2B,则A2B的电子式为________,指出B元素在周期中的位置________④若A、B两元素形成化合物AB2,则B的气态氢化物的电子式为________。
查看习题详情和答案>>
在元素周期表中,位于第三周期第ⅣA族元素A的原子结构示意图是________.元素A的最高价氧化物的化学式是________.元素A的气态氢化物的稳定性比它上一周期同族元素E的气态氢化物________.与A相邻的同一周期的G、J两元素分别是________和________.A、E、G、J四种元素最高价氧化物对应水化物的化学式分别为________、________、________和________.在这四种物质中,________的酸性最弱,________的酸性最强.
查看习题详情和答案>>下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.

试回答下列问题:
(1)第三周期8种元素单质熔点高低顺序如图1,其中序号“8”代表
(2)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.两者相比熔点更高的是
(3)元素c的一种氧化物与元素d的一种氧化物互为等电子体,元素c的氧化物分子式是
(4)i单质晶体中原子的堆积方式如图2甲所示(面心立体最密堆积),其晶胞特征如图2乙所示.则晶胞中i原子的配位数为
查看习题详情和答案>>
| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o |

试回答下列问题:
(1)第三周期8种元素单质熔点高低顺序如图1,其中序号“8”代表
Si
Si
(填元素符号);(2)由j原子跟c原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.两者相比熔点更高的是
SiC
SiC
(填化学式),试从结构角度加以解释:因SiC晶体与Si晶体都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高
因SiC晶体与Si晶体都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高
.(3)元素c的一种氧化物与元素d的一种氧化物互为等电子体,元素c的氧化物分子式是
CO2
CO2
,该分子是由极性
极性
键构成的非极性
非极性
分子(填“极性”或“非极性”);元素d的氧化物的分子式是N2O
N2O
.(4)i单质晶体中原子的堆积方式如图2甲所示(面心立体最密堆积),其晶胞特征如图2乙所示.则晶胞中i原子的配位数为
12
12
,一个晶胞中i原子的数目为4
4
;晶胞中存在两种空隙,分别是正四面体空隙
正四面体空隙
、正八面体空隙
正八面体空隙
.如图是元素周期表的另一种画法--三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置.
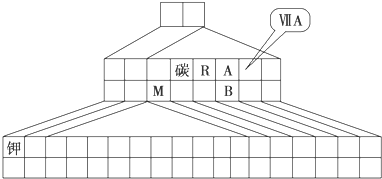
回答下列问题:
(1)请在图中将过渡元素所在的位置涂黑.
(2)M的氧化物含有的化学键为 ,工业上用于冶炼M的化学方程式为 .
(3)M和R组成化合物MR的超细粉末被广泛应用于大规模集成电路生产等领域.其制取原理是用M的氧化物、R的单质与碳单质在高温下反应,已知反应中三种物质的物质的量之比为1:1:3,该反应的化学方程式为 ,反应中 作氧化剂.
(4)图中A、B两元素形成的离子B2A
中,B元素呈现最高价,B原子位于由A原子组
成的四面体的中心,且所有原子的最外层电子均满足8电子结构.该离子可能具有的化学性质是 ,依据是 .
查看习题详情和答案>>

回答下列问题:
(1)请在图中将过渡元素所在的位置涂黑.
(2)M的氧化物含有的化学键为
(3)M和R组成化合物MR的超细粉末被广泛应用于大规模集成电路生产等领域.其制取原理是用M的氧化物、R的单质与碳单质在高温下反应,已知反应中三种物质的物质的量之比为1:1:3,该反应的化学方程式为
(4)图中A、B两元素形成的离子B2A
2- 8 |
成的四面体的中心,且所有原子的最外层电子均满足8电子结构.该离子可能具有的化学性质是