网址:http://m.1010jiajiao.com/timu3_id_397005[举报]
下表是不同温度下水的离子积常数:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a________1×10-14(填“>”、“<”或“=”),做此判断的理由是________________________________________________________________________
(2)25℃时,某Na2SO4溶液中c(SO![]() )=5×10-4 mol/L,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=________。
)=5×10-4 mol/L,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=________。
(3)t2℃时,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=________。
(4)t2℃时, pH均为1的盐酸、醋酸、氯化铵溶液由水电离生成的H+浓度之比为:
(5)25℃时,将amol CH3COONa溶于水,溶液显____性。向该溶液滴加bL醋酸溶液后溶液呈中性,则滴加醋酸的过程中的水的电离平衡将______(填”正向”“不”或“逆向”)移动,所滴加醋酸的浓度为_______mol·L-1。(CH3COOH的电离平衡常数取Ka=2X10-5 mol·L-1)
查看习题详情和答案>> (1)A.NH3 B.SO3 C.Cl2 D.BaSO4 E.酒精 F.CH3COONH4
(1)A.NH3 B.SO3 C.Cl2 D.BaSO4 E.酒精 F.CH3COONH4G.HClO.以上物质中属于非电解质的是
(2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是
(3)在25℃时,有pH为a(a≤6)的盐酸和pH为b(b≥8)的NaOH溶液,取Va L该盐酸,与该NaOH溶液中和,需Vb LNaOH溶液.若a+b>15,则Va:Vb=
(4)已知:CO2+3H2O+2AlO2-=2Al(OH)3↓+CO32-.现有浓度为0.1mol?L-1的五种溶液:
A.Na2CO3;B.NaHCO3;C.NaAlO2;D.CH3COONa;E.NaOH.
这五种溶液的pH由小到大的顺序是
(5)常温下,将0.01mol NH4Cl和0.002mol NaOH溶于水配成1L混合溶液.该溶液中存在的三个平衡体系,它们是:水的电离H2O?H++OH-、
(1)向氯化铁溶液中加入碳酸氢钠溶液,发现有红褐色沉淀生成,并产生无色气体,其离子方程式为 。
(2)向盛有1mL 0.1mol/L MgCl2溶液的试管中滴加2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置。可以观察到白色沉淀转变为红褐色沉淀。简述产生该现象的原因: 。
(3)常温下,如果取0.1mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,求出混合液中下列算式的精确计算结果(填具体数字): c(OH-)-c(HA)= mol/L。
(4)已知25℃时,AgCl的溶解度为1.435×10-4g,则该温度下AgCl的溶度积常数
Ksp= mol2/L2。
电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
(6)向NaCN溶液中通入少量CO2,所发生反应的化学方程式为 。 查看习题详情和答案>>
化学学科中的平衡理论主要包括:化学平衡、电离平衡和水解平衡三种,且均符合勒夏特列原理。请回答下列问题:
Ⅰ、在恒容密闭容器中,发生反应3A(g)+B(g) 2C(g) ΔH=Q kJ/mol。回答下列问题:
2C(g) ΔH=Q kJ/mol。回答下列问题:
(1)写出该反应平衡常数的表达式__________。
(2)下列各项能作为判断该反应达到化学平衡状态的依据是________(填序号)。
① v(A)=3v(B) ②混合气体的密度保持不变
③有3 mol A消耗的同时有1 mol B生成 ④C的浓度保持不变
(3)根据实验测得的数据可知,温度越高该反应的化学平衡常数越大,则Q______0(填“大于”或“小于”)。
Ⅱ、(1)室温下,取pH=2的盐酸和醋酸溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是________(填 “a”或“b”)。设盐酸中加入Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1________m2(选填“<”、“=”或“>”)。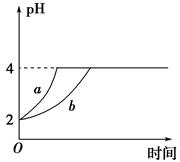
(2)若室温下pH=2的盐酸和醋酸溶液各 100 mL,分别加水稀释后使pH=4,设盐酸中加入水的体积为V1,醋酸溶液中加入的水的体积为V2,则 V1______V2(填“<”“=”或“>”)。
Ⅲ、常温下,浓度均为0.1 mol/L 的下列六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
(2)根据表中数据判断,浓度均为0.01 mol/L 的下列五种物质的溶液中,酸性最强的是_______ (填编号) ; 将各溶液分别稀释100倍, pH变化最小的是 (填编号) 。
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
(3)据上表数据,请你判断下列反应不能成立的是 (填编号)。
A.CH3COOH+ Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+2C6H5 ONa=Na2CO3+2C6H5OH
Ⅳ、已知:ZnCl2·xH2O易溶于水,且其浓的水溶液呈较强酸性;SOCl2 (氯化亚砜)极易和水发生如下反应:SOCl2+H2O=SO2+2HCl。实验室中制取无水氯化锌采用ZnCl2·xH2O与SOCl2混合加热的方法。试回答:
SOCl2的作用是___________________________________。 查看习题详情和答案>>
(1)向氯化铁溶液中加入碳酸氢钠溶液,发现有红褐色沉淀生成,并产生无色气体,其离子方程式为 。
(2)向盛有1mL 0.1mol/L MgCl2溶液的试管中滴加2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置。可以观察到白色沉淀转变为红褐色沉淀。简述产生该现象的原因: 。
(3)常温下,如果取0.1mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,求出混合液中下列算式的精确计算结果(填具体数字): c(OH-)-c(HA)= mol/L。
(4)已知25℃时,AgCl的溶解度为1.435×10-4g,则该温度下AgCl的溶度积常数
Ksp= mol2/L2。
电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
|
化学式 |
电离常数(25℃) |
|
HCN |
K=4.9×10-10 |
|
CH3COOH |
K=1.8×10-5 |
|
H2CO3 |
K1=4.3×10-7、K2=5.6×10-11 |
(5)25℃时,有等物质的量浓度的A. Na2CO3溶液、B. NaCN溶液、C.CH3COONa溶液,三溶液的pH由大到小的顺序为 。(用字母表示)
(6)向NaCN溶液中通入少量CO2,所发生反应的化学方程式为 。
查看习题详情和答案>>