网址:http://m.1010jiajiao.com/timu3_id_396743[举报]
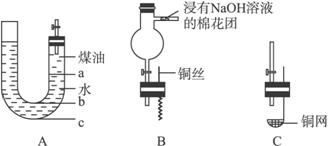
请完成下列问题:
(1)怎样检验A装置的气密性____________________。
(2)液体药品添加完毕后,关闭活塞,打开右边胶塞,向煤油中加入一小块钠,立即塞好胶塞。反应开始前钠的位置在________(填“a”“b”或“c”)处。
(3)反应后,钠在煤 油和水层界面之间上下跳动,反应平缓连续进行,试说明产生上述现象的原因____________________________。
(4)当钠与水完全反应后,无须验纯,可直接打开活塞点燃以检验生成的气体,其原因是
__________________________。
(5)如果要检验钠与水反应有碱生成,应如何操作,请写出操作步骤并说明现象和结论:
________________________________________。
(6)如果把A装置右端管口胶塞换成B装置,可用于铜与稀HNO3反应的实验,以验证生成的NO无色并同时检验NO的性质,已知反应2NO(无色)+O2====2NO2(红棕色)。
①反应开始前,先将球形管上面的活塞打开,从U形管长管口注入稀HNO3,一直注到________为止,关闭活塞。
②在什么情况下反应可自动停止:____________________。
③如果再将活塞慢慢打开,可立即观察到哪些明显现象:__________________。
④球形管侧边导管中放着浸有NaOH溶液的棉花团的作用是__________________________。
(7)如果把A装置胶塞换成C装置,该装置适用于室温下用块状固体和液体反应制备气体,且制备气体时可随制随停。则用该装置制备气体时,块状固体放在________________,可制备的气体有________________。
查看习题详情和答案>>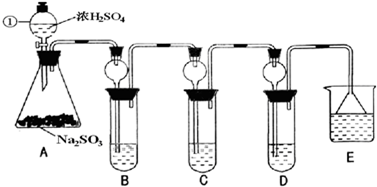
(1)指出仪器①的名称
(2)检查A装置的气密性的方法是
(3)装置B检验SO2的氧化性,则B中所盛试剂可以为
(4)装置C中盛装溴水用以检验SO2的
(5)装置D中盛装新制漂白粉浓溶液通入SO2一段吋间后,D中出现了大量白色沉淀.同学们对白色沉淀成分提出三种假设:
①假设一:该白色沉淀为CaSO3
假设二:该白色沉淀为
假设三:该白色沉淀为上述两种物质的混合物.
②基于假设一,同学们对白色沉淀成分进行了探究.设计如下方案:
限选的仪器和试剂;过滤装置、试管、滴管、带导管的单孔塞、蒸馏水、0.5mol.L-1 HCl、0.5mol.L-1 H2SO4、0.5mol.L-1BaCl2、1mol.L-1 NaOH、品红溶液.
第1步,将D中沉淀过滤、洗涤干净,备用.
请回答洗涤沉淀的方法:
第2步,用另一只干净试管取少量沉淀样品,加入
若出现
③若假设二成立,试写出生成该白色沉淀的化学方程式:
(6)装置E中盛放的试剂是
硅酸钠是硅酸盐的代表物,教材中设计实验探究了硅酸钠与酸的反应和硅酸钠的防火性.在教材实验的基础上,我们适当拓展,整合实验验证硅酸钠的性质.
[实验目的]探究硅酸钠的性质
[实验原理]硅酸钠可以与酸反应
[实验仪器]试管、胶头滴管、分液漏斗、导管、洗气瓶、烧杯、滤纸、激光笔、玻璃片、表面器皿等
[选用药品]饱和硅酸钠溶液、1 mol/L盐酸、石灰石、饱和碳酸氢钠溶液、酚酞溶液、蒸馏水、氯化钙溶液、饱和碳酸钠溶液等
[实验步骤](1)按下图所示安装实验装置.

(2)检验装置气密性:在B、C、D中装入适量蒸馏水,浸没导管口,关闭分液漏斗的活塞,用酒精灯微热烧瓶,若观察到B、C、D的导管口都产生气泡,停止微热,D烧杯中的导管形成一段水柱,表明装置的气密性良好.
(3)装入药品进行实验.观察现象并填写下表:

酸性:
HCl>H2CO3>H2SiO3.(4)在另一只烧杯E中装入饱和硅酸钠溶液,与D烧杯做对照实验:在暗处,用激光笔照射D、E烧杯里的液体,观察现象.
现象及结论:可以观察到D烧杯的液体发生了丁达尔现象,说明生成的硅酸在水中形成的是胶体.
(5)取甲、乙两支试管,分别装入相同体积的饱和硅酸钠溶液,甲中加入几滴盐酸、乙中加入几滴氯化钙溶液,观察现象.然后分别加入足量的氢氧化钠溶液,再观察现象.
现象及结论:甲中出现白色沉淀,后白色沉淀溶解;乙中也出现白色沉淀,但沉淀不溶解.有关的化学方程式为Na2SiO3+2HCl![]() 2NaCl+H2SiO3(胶体)+2NaCl,H2SiO3+2NaOH
2NaCl+H2SiO3(胶体)+2NaCl,H2SiO3+2NaOH![]() Na2SiO3+2H2O,Na2SiO3+CaCl2
Na2SiO3+2H2O,Na2SiO3+CaCl2![]() CaSiO3↓+2NaCl.
CaSiO3↓+2NaCl.
(6)取两块玻璃片,在一块玻璃片上滴几滴饱和硅酸钠溶液,将另一块玻璃片盖在上面,片刻后,移动玻璃片,观察现象.
现象:两块玻璃片粘在一起,不能移动.
(7)取三张分别被蒸馏水、饱和硅酸钠溶液、饱和碳酸钠溶液充分浸泡过的滤纸(分别记为A、B、C),取出稍沥干(不再滴液)后同时分别放在酒精灯火焰上点燃,观察现象.

[实验结论]根据上述实验说明硅酸钠可以溶于水,它的水溶液呈碱性且具有粘合性、防火性;硅酸钠与碳酸、盐酸等酸反应会生成硅酸,硅酸是弱酸,难溶于水,在水中可以形成胶体.硅酸钙难溶于水.
[问题与讨论](1)如果拆掉上述实验装置B,能否证明碳酸的酸性比硅酸的强?
(2)硅酸钠溶液为什么俗称“泡花碱”?
(3)设计一个简单的实验探究硅酸钠、碳酸钠溶液的碱性强弱.简述实验步骤、现象、结论.
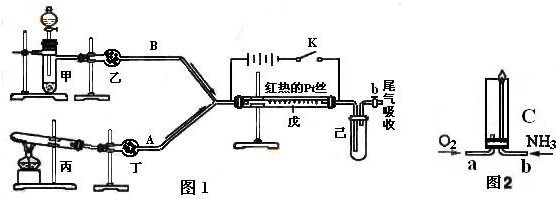
根据图1中装置和反应现象请回答:
(1)若乙中盛有P2O5,此时丙装置中发生反应的化学方程式为
| ||
| ||
(2)检验甲装置气密性的方法
(3)当己中充满红棕色气体后,停止甲、丙装置中的反应,并关闭a、b两个活塞,将己装置浸入冰水中,出现的现象是
(4)已知氨气在纯氧中安静的燃烧,如图2,将过量O2与NH3分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气.先通入O2,后通过NH3的理由是
(5)液氨与水性质颇为相似,其电离方程式可表示为:2NH3?NH4++NH2-.某温度下其离子积常数为1×10-30(mol?L-1)2.液氨中的pNH4与水中的pH类似,向1L液氨中加入2.3gNa此时上述平衡

如果用图Ⅰ中装置进行铜与浓硝酸反应的实验,最大缺点是产生的NO2气体逸出污染空气;如果用该装置来证明铜与稀硝酸反应生成NO气体,缺点是不易观察到有毒性的NO气体无色的本来面目。
(1)若用装置Ⅱ进行实验,既可克服实验不足,还能使上述反应在同一试管中连续进行。实验如下:组装好装置并检查气密性后,加入2 mL浓硝酸(铜片未接触酸液),塞紧胶塞;向左倾斜试管使其反应发生,当导管口有极少量红棕色气体逸出,溶液呈绿色时,正立试管,使反应停止;同时将导管插入水中,稍后能观察到:a.水沿导管倒吸至试管中,b.________________,c. ________________等明显现象。其中发生的原因用方程式表示为:_________________________________________________________。
(2)当试管中液体体积约占1/2时,从水中取出导管,并伸入一小试管中,管口塞上浸有碱液的棉花(如图Ⅲ)。这样做的目的是:________________,此时大试管中反应的离子方程式为:________________________________________________。
(3)若用右上图Ⅳ所示的装置(U形管、干燥管、A为活塞)制取NO可能更加理想。请补充下列实验步骤:
①检查装置的气密性的方法是:________________________________________________。
②打开活塞A,从U形管右端注入稀硝酸,直到________________________为止。
③关闭活塞A,若反应缓慢,可在U形管左侧加热,观察到____________________。
查看习题详情和答案>>