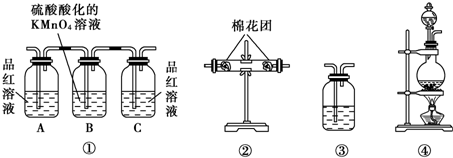
题目内容
用如下图A的实验装置可以进行钠与水的反应实验,并可收集、检验生成的气体。 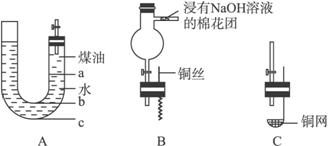
请完成下列问题:
(1)怎样检验A装置的气密性____________________。
(2)液体药品添加完毕后,关闭活塞,打开右边胶塞,向煤油中加入一小块钠,立即塞好胶塞。反应开始前钠的位置在________(填“a”“b”或“c”)处。
(3)反应后,钠在煤 油和水层界面之间上下跳动,反应平缓连续进行,试说明产生上述现象的原因____________________________。
(4)当钠与水完全反应后,无须验纯,可直接打开活塞点燃以检验生成的气体,其原因是
__________________________。
(5)如果要检验钠与水反应有碱生成,应如何操作,请写出操作步骤并说明现象和结论:
________________________________________。
(6)如果把A装置右端管口胶塞换成B装置,可用于铜与稀HNO3反应的实验,以验证生成的NO无色并同时检验NO的性质,已知反应2NO(无色)+O2====2NO2(红棕色)。
①反应开始前,先将球形管上面的活塞打开,从U形管长管口注入稀HNO3,一直注到________为止,关闭活塞。
②在什么情况下反应可自动停止:____________________。
③如果再将活塞慢慢打开,可立即观察到哪些明显现象:__________________。
④球形管侧边导管中放着浸有NaOH溶液的棉花团的作用是__________________________。
(7)如果把A装置胶塞换成C装置,该装置适用于室温下用块状固体和液体反应制备气体,且制备气体时可随制随停。则用该装置制备气体时,块状固体放在________________,可制备的气体有________________。
(1)塞紧胶塞并关闭导气管上的活塞,从U形管的长管口(左端管口)注入水至水面高于右端管口,如果U形管右端有一段空气柱没有被水充满,则气密性良好
(2)a
(3)当钠与水剧烈反应时,生成的氢气在钠表面形成气泡,由于浮力作用钠进入煤油层,反应停止,氢气逸出,钠在重力作用下又回落到水面上,反应又进行,如此反复,使钠在煤油和水层界面之间上下跳动且反应平缓连续进行
(4)此反应在隔绝空气下进行,生成的氢气中不含空气
(5)打开胶塞,倒出煤油,向U形管短管口中滴入酚酞,溶液变红,即证明钠与水反应有碱生成(其他合理答案也给分)
(6)①液面刚到达活塞处
②铜丝与稀HNO3液面脱离
③U形管左边液面下降,右边液面上升;球形管中气体颜色逐渐变红棕色;铜丝被稀HNO3浸没,有无色气泡产生
④吸收NO和NO2,防止NO和NO2逸出而污染空气
(7)铜网中 H2、CO2

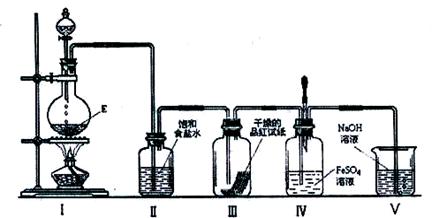
(13分)过氧化钠(化学式为NaNa2O2)可用在呼吸面具中作为氧气来源。Na2O2能跟CO2反应生成O2和另一种固体化合物(用X表示);它也能跟H2O反应生成O2,化学方程式为:2Na2O2+2H2O = 4NaOH+O2↑。以下是某兴趣小组进行的探究活动。
(1)利用如下图所示实验装置制取氧气,请回答有关问题。
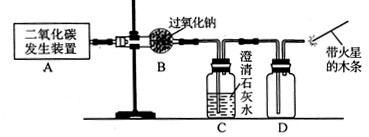
①实验室制取CO2的化学方程式为 。
②表明CO2未被Na2O2完全吸收的实验现象为 。
③O2可采用D装置收集,并用带火星的木条检验,这是利用了O2的 性质。
④若A装置产生的CO2中混有水蒸气,要检验干燥的CO2能否与Na2O2反应生成O2,以上实验装置应如何改进
(2)为探究X是哪种物质及其有关性质,同学们进行了如下分析和实验。
①有同学猜想X可能是酸、碱或盐中的一种。通过对物质组成的分析,大家一致认为X肯定不是酸和碱,理由是 。
②同学们通过讨论和实验证明了X是Na2CO3。以下是他们设计的有关Na2CO3性质的探究实验,将下表填写完整。
|
实验操作 |
现 象 |
有关的化学方程式 |
|
实验一:取少量固体样品,
|
澄清石灰水变浑浊 |
Na2CO3+2HCl=2NaCl+H2O+CO2↑ CO2+Ca(OH)2=CaCO3↓+H2O |
|
实验二:取少量固体样品, 加水配成溶液,滴加适量的 溶液 |
有白色沉淀产生
|
|
(3)7.8g过氧化钠与足量的水反应,生成氧气的质量是多少?若反应后得到了40g氢氧化钠溶液,请计算氢氧化钠溶液中溶质的质量分数。