摘要:20.在一固定容积的密闭容器中进行着如下反应: CO2(g) + H2(g) CO(g) + H2O(g) 其平衡常数K和温度t的关系如下: t℃ 700 800 850 1000 1200 K 2.6 1.7 1.0 0.9 0.6 (1) K的表达式为: , (2) 该反应的正反应为 反应 (3) 能判断该反应是否已经达到化学平衡状态的是: A.容器中压强不变 B.混合气体中CO浓度不变 C.v(H2)正 = v(H2O)逆 D.c(CO2) = c(CO) (4) 在850℃时.可逆反应:CO2(g) + H2(g) CO(g) + H2O(g).在该容器内各物质的浓度变化如下: 时间/min CO2 H2 CO H2 O ( mol/L) 0 0.200 0.300 0 0 2 0.138 0.238 0.062 0.062 3 c1 c2 c3 c3 4 c1 c2 c3 c3 计算:3min-4min达到平衡时CO的平衡浓度c3和CO2 (g)的转化率.要求写出简单的计算过程(c3精确到小数点后面三位数).
网址:http://m.1010jiajiao.com/timu3_id_396483[举报]
在一固定容积的密闭容器中进行着如下反应:CO2(g)+H2(g)?CO(g)+H2O(g)其平衡常数K和温度t的关系如下:
(1)K的表达式为:
(2)该反应的正反应为
(3)能判断该反应是否已经达到化学平衡状态的是:
A.容器中压强不变
B.混合气体中CO浓度不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=C(CO)
(4)在850℃时,可逆反应:CO2(g)+H2(g)?CO(g)+H2O(g),在该容器内各物质的浓度变化如下:
计算:3min-4min达到平衡时CO的平衡浓度c3=
查看习题详情和答案>>
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
K=
| c(CO)c(H2O) |
| c(CO2)c(H2) |
K=
;| c(CO)c(H2O) |
| c(CO2)c(H2) |
(2)该反应的正反应为
放热
放热
反应(“吸热”或“放热”);(3)能判断该反应是否已经达到化学平衡状态的是:
BC
BC
A.容器中压强不变
B.混合气体中CO浓度不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=C(CO)
(4)在850℃时,可逆反应:CO2(g)+H2(g)?CO(g)+H2O(g),在该容器内各物质的浓度变化如下:
| 时间/min | CO2(mol/L) | H2(mol/L) | CO(mol/L) | H2O(mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
0.12mol/L
0.12mol/L
和CO2(g)的转化率为60%
60%
.在一固定容积的密闭容器中进行着如下反应:CO2(g)+H2(g)?CO(g)+H2O(g),其平衡常数K和温度t的关系如下:
(1)K的表达式为:
;
(2)该反应的正反应为
(3)能判断该反应是否已经达到化学平衡状态的是:
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正=v(H2O)逆 D.c(CO2)=c(CO)
E.容器中气体密度不变 F.1mol H-H键断裂的同时断裂2mol H-O键
(4)在850℃时,可逆反应:CO2(g)+H2(g)?CO(g)+H2O(g),在该容器内各物质的浓度变化如下:
计算:CO的平衡浓度c3,要求写出简单的计算过程.
查看习题详情和答案>>
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
| c(CO)?c(H2O) |
| c(CO)2?c(H2) |
| c(CO)?c(H2O) |
| c(CO)2?c(H2) |
(2)该反应的正反应为
放热
放热
反应(“吸热”或“放热”)(3)能判断该反应是否已经达到化学平衡状态的是:
B C F
B C F
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正=v(H2O)逆 D.c(CO2)=c(CO)
E.容器中气体密度不变 F.1mol H-H键断裂的同时断裂2mol H-O键
(4)在850℃时,可逆反应:CO2(g)+H2(g)?CO(g)+H2O(g),在该容器内各物质的浓度变化如下:
| 时间/min | CO2 (mol/L) | H2 (mol/L) | CO (mol/L) | H2O(mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
在一固定容积的密闭容器中进行着如下反应: CO2(g) + H2(g) CO(g)+ H2O(g) ;其平衡常数K和温度t的关系如下:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1) K的表达式为: ;
(2) 该反应的正反应为 反应(“吸热”或“放热”);
(3) 能判断该反应是否已经达到化学平衡状态的是:
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正 = v(H2O)逆 D.c(CO2)= c(CO)
(4) 在850℃时,可逆反应:CO2(g)+ H2(g) CO(g)+ H2O(g),在该容器内各物质的浓度变化如下:
| 时间/min | CO2 (mol/L) | H2 (mol/L) | CO (mol/L) | H2 O ( mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
计算:3min—4min达到平衡时CO的平衡浓度c3和CO2 (g)的转化率,要求写出简单的计算过程(c3精确到小数点后面三位数)。
查看习题详情和答案>>
在一固定容积的密闭容器中进行着如下反应: CO2(g) + H2(g) 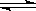 CO(g) + H2O(g) ;其平衡常数K和温度t的关系如下:
CO(g) + H2O(g) ;其平衡常数K和温度t的关系如下:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(2) 该反应的正反应为 反应(“吸热”或“放热”);
(3) 能判断该反应是否已经达到化学平衡状态的是:
A.容器中压强不变 B.混合气体中CO浓度不变
C.v(H2)正 = v(H2O)逆 D.c(CO2) = c(CO)
(4) 在850℃时,可逆反应:CO2(g) + H2(g)
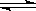 CO(g) + H2O(g),在该容器内各物质的浓度变化如下:
CO(g) + H2O(g),在该容器内各物质的浓度变化如下:| 时间/min | CO2 (mol/L) | H2 (mol/L) | CO (mol/L) | H2O ( mol/L) |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
在一固定容积的密闭容器中进行着如下反应:
CO2(g) + H2(g) 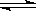 CO(g) + H2O(g) 其平衡常数K和温度t的关系如下:
CO(g) + H2O(g) 其平衡常数K和温度t的关系如下:
| t℃ | 700 | 800 | 850 | 1000 | 1200 |
| K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(2) 该反应的正反应为 反应(“吸热”或“放热”);
(3)下列选项中可作为该反应在850℃时已经达到化学平衡状态的标志的是:
A.容器中压强不再变化 B.混合气体中CO浓度不再变化
C.混合气体的密度不再变化 D.c(CO2) =" c(CO)=" c(H2) = c(H2O)
(4)当温度为850℃,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO | H2O | CO2 | H2 |
| 0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
 此时上述的反应中正、逆反应速率的关系式是 (填代号)。
此时上述的反应中正、逆反应速率的关系式是 (填代号)。a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断 查看习题详情和答案>>