网址:http://m.1010jiajiao.com/timu3_id_396208[举报]
请回答下列问题:
(1)元素C在周期表中的位置是第
(2)Y的电子式为


(3)比较F和E形成简单离子的半径大小:
(4)一定条件下,A单质和D单质在E的最高价氧化物对应水化物的浓溶液中可以形成燃料电池.请写出该燃料电池的负极反应式:
(5)X的空间构型为
| 2b |
| a |
| 2b |
| a |
短周期元素A、B、C、D、E、F的原子序数依次增大,其中A为周期表中原子半径最小的元素;B原子的最外层电子排布为nsnnpn;C是地壳中含量最高的元素;Cn-、D+、E3+具有相同的电子层结构,E、F的质子数之和是Cn-电子数的3倍.试回答下列问题:
(1)A与B组成的一种分子中所有原子共直线,该分子中B原子杂化方式是________.
(2)D与F形成的化合物其晶体结构模型如图,它代表该晶体的一个结构单元.(图中小黑点、小白圈分别代表阴、阳离子)
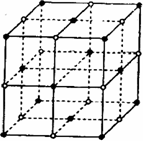
①此结构单元中与D+距离最近且相等的D+离子个数为________.
②已知该晶体的密度为r g/cm3,该化合物摩尔质量Mg/mol,阿伏加德罗常数为NA,则在该晶体里距离最近的阳离子和阴离子之间的核间距大约是:________cm.
(3)我国首创利用C、E两元素单质在海水中的反应所设计的原电池广泛运用于海水标示灯,该电池的正极反应式为________.
 短周期元素A、B、C、D、E、F,原子序数依次增大.已知:①A与E同主族,E的单质与D2反应可生成E2D和E2D2两种固体;②F的单质在D2中燃烧的产物可使品红溶液褪色;B的单质在D2中燃烧可生成BD和BD2两种气体;③CA4++DA-=CA3↑+A2D,各种反应和生成物的电子数都与E+相等.请回答下列问题:
短周期元素A、B、C、D、E、F,原子序数依次增大.已知:①A与E同主族,E的单质与D2反应可生成E2D和E2D2两种固体;②F的单质在D2中燃烧的产物可使品红溶液褪色;B的单质在D2中燃烧可生成BD和BD2两种气体;③CA4++DA-=CA3↑+A2D,各种反应和生成物的电子数都与E+相等.请回答下列问题:(1)BD2的结构式为


(2)废旧印刷电路板上含有铜,以往回收的方法是将其灼烧使用铜转化为氧化铜,再用稀硫酸来溶解.现改用A2D2和稀硫酸浸泡即达目的,又保护了环境,其反应的化学方程式为
(3)在火箭推进器中装有强还原剂C2A4和强氧化剂A2D2,已知0.5mol液态C2A4和足量液态A2D2反应,生成一种无色无味无毒的气体和水蒸气,放出320kJ热量,写出该反应的热化学方程式
(4)离子化合物CA5的电子式为


| ||
| 2 |
| 3 |
| ||
| ||
| 2 |
| 3 |
| ||
(1)A、C、D形成的化合物中含有的化学键类型为 ;W的电子式 。
(2)已知:①2E → E-E;
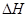 =-a kJ·mol-1 ② 2A → A-A;
=-a kJ·mol-1 ② 2A → A-A;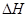 =-b kJ·mol-1
=-b kJ·mol-1③E+A → A-E;
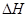 =-c kJ·mol-1
=-c kJ·mol-1写出298K时,A2与E2反应的热化学方程式 。
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g)
 X(g);
X(g);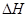 =-a KJ·mol-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
=-a KJ·mol-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2 mol A2、1 mol BC | 1 mol X | 4 mol A2、2 mol BC |
| 平衡时n(X) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | 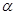 1 1 | 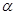 2 2 |  3 3 |
①在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则A2的平均反应速率
 ( A2)为 。
( A2)为 。②该温度下此反应的平衡常数K的值为 。
③下列现象能说明甲容器中的反应已经达到平衡状态的有 (填序号)。
A.内A2、BC、X的物质的量之比为2:1:1
B.内气体的密度保持恒定
C.内A2气体的体积分数保持恒定
D.2 V正(A2)=V逆(BC)
④三个容器中的反应分别达平衡时各组数据关系正确的是 (填序号)。
A.α1+α2=1 B.Q1+Q2=a C.α3<α1
D.P3<2P1=2P2 E.n2<n3<1.0mol F.Q3=2Q1
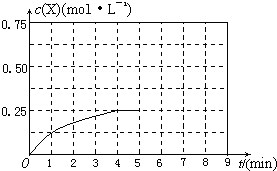
(4)在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为75%,请在上图中画出第5min 到新平衡时X的物质的量浓度的变化曲线。
四种短周期元素A、B、C、D,原子序数依次增大,结合下列信息:
(1)A的最高价氧化物对应的水化物E与其气态氢化物F反应,得到离子化合物G。
(2)B的焰色应呈黄色。
(3)C在同周期主族元素形成的简单离子中,离子半径最小.
(4)D最高正价与最低负价之和为零.
回答下列问题:
(1)写出D在元素周期表中的位置:
(2)写出化合物F的电子式 ,结构式
(3)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是 (填元素符号)
(4)下列可作为比较元素B和C金属性强弱的依据是 ( 填序号)
a.自然界中的含量b.相应氯化物水溶液的pH
c.单质与水反应的难易程度 d.单质与酸反应时失去的电子数
A的一种氢化物HA3可用于有机合成,其酸性与醋酸相似,体积和浓度均相等的HA3与B的最高价 氧化物对应的水化物的溶液混合,反应的化学方程式是 混合后溶液中离子浓度由大到小的顺序是