摘要:溶解度曲线:以温度为横坐标.溶解度为纵坐标形象地看出物质的溶解度随温度变化情况. (1) 大多数物质的溶解度随着温度的升高而增大 ①影响很大.如硝酸钾.表现为曲线陡 ②影响不大.如氯化钠.表现为曲线平缓 (2) 极少数物质的溶解度随着温度的升高而减小.如氢氧化钙
网址:http://m.1010jiajiao.com/timu3_id_3961884[举报]
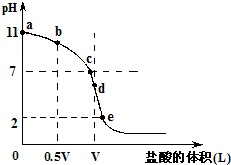 常温,向浓度为0.1mol/L,体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题:
常温,向浓度为0.1mol/L,体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题:(1)氨水的电离方程式为
NH3?H2O?NH4++OH-
NH3?H2O?NH4++OH-
,该温度时氨水的电离平衡常数K=10-5
10-5
.(2)比较b、c、d三点时的溶液中,水电离的c(OH-)大小顺序为
d>c>b
d>c>b
.(3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的有
ACD
ACD
.A.c(H+)?c(OH-) B.
| c(H+) |
| c(OH-) |
| c(NH4+)?c(OH-) |
| c(NH3H2O) |
| c(NH3H2O)?c(H+) |
| c(NH4+) |
(4)根据以上滴定曲线判断下列说法正确的是(溶液中N元素只存在NH4+和NH3.H2O两种形式)
D
D
.A.点b所示溶液中:c(NH4+)+c(H+)=c(NH3.H2O)+c(OH-)
B.点c所示溶液中:c(Cl-)=c(NH3.H2O)+c(NH4+)
C.点d所示溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.滴定中可能有:c(NH3.H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)
(5)滴定过程中所用盐酸的pH=
1
1
,d点之后若继续加入盐酸至图象中的e点(此时不考虑NH4+水解的影响),则e点对应的横坐标为| 11V |
| 9 |
| 11V |
| 9 |
常温,向浓度为0.1mol/L,体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题:
(1)氨水的电离方程式为______,该温度时氨水的电离平衡常数K=______.
(2)比较b、c、d三点时的溶液中,水电离的c(OH-)大小顺序为______.
(3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的有______.
A.c(H+)?c(OH-) B.
C.
D.
(4)根据以上滴定曲线判断下列说法正确的是(溶液中N元素只存在NH4+和NH3.H2O两种形式)______.
A.点b所示溶液中:c(NH4+)+c(H+)=c(NH3.H2O)+c(OH-)
B.点c所示溶液中:c(Cl-)=c(NH3.H2O)+c(NH4+)
C.点d所示溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.滴定中可能有:c(NH3.H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)
(5)滴定过程中所用盐酸的pH=______,d点之后若继续加入盐酸至图象中的e点(此时不考虑NH4+水解的影响),则e点对应的横坐标为______.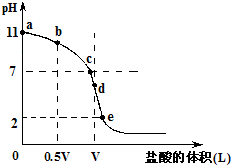
查看习题详情和答案>>
(1)氨水的电离方程式为______,该温度时氨水的电离平衡常数K=______.
(2)比较b、c、d三点时的溶液中,水电离的c(OH-)大小顺序为______.
(3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的有______.
A.c(H+)?c(OH-) B.
| c(H+) |
| c(OH-) |
| c(NH4+)?c(OH-) |
| c(NH3H2O) |
| c(NH3H2O)?c(H+) |
| c(NH4+) |
(4)根据以上滴定曲线判断下列说法正确的是(溶液中N元素只存在NH4+和NH3.H2O两种形式)______.
A.点b所示溶液中:c(NH4+)+c(H+)=c(NH3.H2O)+c(OH-)
B.点c所示溶液中:c(Cl-)=c(NH3.H2O)+c(NH4+)
C.点d所示溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.滴定中可能有:c(NH3.H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)
(5)滴定过程中所用盐酸的pH=______,d点之后若继续加入盐酸至图象中的e点(此时不考虑NH4+水解的影响),则e点对应的横坐标为______.

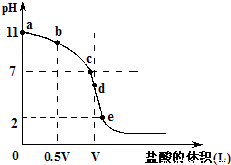 常温,向浓度为0.1mol/L,体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题:
常温,向浓度为0.1mol/L,体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题:(1)氨水的电离方程式为______,该温度时氨水的电离平衡常数K=______.
(2)比较b、c、d三点时的溶液中,水电离的c(OH-)大小顺序为______.
(3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的有______.
A.c(H+)?c(OH-) B.
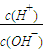 C.
C.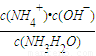 D.
D.
(4)根据以上滴定曲线判断下列说法正确的是(溶液中N元素只存在NH4+和NH3.H2O两种形式)______.
A.点b所示溶液中:c(NH4+)+c(H+)=c(NH3.H2O)+c(OH-)
B.点c所示溶液中:c(Cl-)=c(NH3.H2O)+c(NH4+)
C.点d所示溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.滴定中可能有:c(NH3.H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)
(5)滴定过程中所用盐酸的pH=______,d点之后若继续加入盐酸至图象中的e点(此时不考虑NH4+水解的影响),则e点对应的横坐标为______.
查看习题详情和答案>>
(15分)钌(Ru)的硫化物可用元素合成法(下称干法)和湿法获得。干法用99.9%的纯钌粉和99.99%的硫按化学计量配料,充分混合,置于石英管中,抽真空并加热至800℃反应生成,经X-射线检定为晶态。湿法:可在六氟合钉(Ⅳ)酸溶液中,加硫代乙酰胺CH3-![]() -NH2水解沉淀生成,X射线检定为非晶态。制得的两种硫化物,在较高温度下用氢气还原,生成的H2S利用库仑滴定法进行测定,可计算出硫量,还原后得到的金属钌进行称量测定。两种方法制得的硫化物在空气中都有微吸湿性,利用失重法可计算出化合物的含水量。其实验数据如下:
-NH2水解沉淀生成,X射线检定为非晶态。制得的两种硫化物,在较高温度下用氢气还原,生成的H2S利用库仑滴定法进行测定,可计算出硫量,还原后得到的金属钌进行称量测定。两种方法制得的硫化物在空气中都有微吸湿性,利用失重法可计算出化合物的含水量。其实验数据如下:
试样组成 | S | Ru | H2O |
(1)干法 | 37.26% | 60.06% | 2.73% |
(2)湿法 | 20.63% | 41.84% | 37.36% |
1.试推断干法和湿法制得的两种硫化物的化学式。
2.写出湿法制备硫化物的反应方程式(要求配平)。
3.哪种方法制得的硫化物测定结果偏高?导致结果偏高的原因可能是什么?
4.用氢还原钌的硫化物,每升温20℃,保温5分钟,同时库仑滴定这一期间释放的H2S量,直到无H2S逸出,化合物还原为金属钌为止。若以滴定S2-离子的时间(s)为纵坐标,温度(℃)为横坐标作图,得钌硫化物被氢还原的反应速率相对于温度的动力学曲线,如下图:
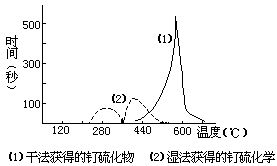
据此,比较两种硫化物对氢作用的稳定性
5.图中湿法制得的硫化物有两个脱硫峰,而且由第一个峰测得的硫含量大约为化合物含硫总量的1/3。据此,推测氢还原湿法制得的钌硫化物的过程。
6.图中(2)的第二个脱硫峰的温度区间比(1)脱硫峰要低,其可能原因是什么?
查看习题详情和答案>>