题目内容
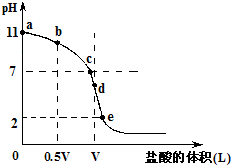
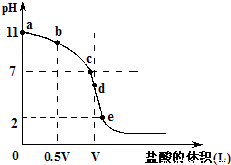
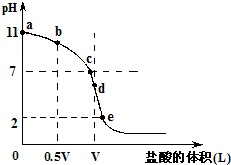 常温,向浓度为0.1mol/L,体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题:
常温,向浓度为0.1mol/L,体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题:(1)氨水的电离方程式为
NH3?H2O?NH4++OH-
NH3?H2O?NH4++OH-
,该温度时氨水的电离平衡常数K=10-5
10-5
.(2)比较b、c、d三点时的溶液中,水电离的c(OH-)大小顺序为
d>c>b
d>c>b
.(3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的有
ACD
ACD
.A.c(H+)?c(OH-) B.
| c(H+) |
| c(OH-) |
| c(NH4+)?c(OH-) |
| c(NH3H2O) |
| c(NH3H2O)?c(H+) |
| c(NH4+) |
(4)根据以上滴定曲线判断下列说法正确的是(溶液中N元素只存在NH4+和NH3.H2O两种形式)
D
D
.A.点b所示溶液中:c(NH4+)+c(H+)=c(NH3.H2O)+c(OH-)
B.点c所示溶液中:c(Cl-)=c(NH3.H2O)+c(NH4+)
C.点d所示溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.滴定中可能有:c(NH3.H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+)
(5)滴定过程中所用盐酸的pH=
1
1
,d点之后若继续加入盐酸至图象中的e点(此时不考虑NH4+水解的影响),则e点对应的横坐标为| 11V |
| 9 |
| 11V |
| 9 |
分析:(1)根据氨水电离生成氢氧根离子和铵根离子;根据滴定前氨水中C(H+)=10-11mol/L,利用水的离子积得C(OH-)=
mol/L=10-3mol/L,最后根据氨水的电离平衡常数K=
来计算;
(2)比较b、c、d三点时的溶液中溶质对水的电离平衡的影响;
(3)滴定时,由b点到c点的过程中,根据水的离子积常数、氨水的电离平衡、氯化铵的水解平衡只与温度有关来分析;
(4)A、由图象可知,点b反应后溶液是NH4C1与NH3?H2O物质的量之比为1:1的混合物,溶液呈碱性,说明NH3?H2O电离程度大于NH4C1的水解程度,由电荷守恒可知:c(C1-)+c(OH-)=c(NH4+)+c(H+),物料守恒为:2c(C1-)=c(NH4+)+c(NH3.H2O),质子守恒为:2c(OH-)+c(NH3.H2O)=c(NH4+)+2c(H+);
B、由电荷守恒可知:c(C1-)+c(OH-)=c(NH4+)+c(H+),由图象可知,点c pH=7,即c(H+)=c(OH-),故c(NH4+)=c(C1-);
C、由图象可知,点d体积相同,则恰好完全反应生成NH4C1,利用盐的水解来分析溶液呈酸性,则c(C1-)>c(NH4+)>c(H+)>c(OH-);
D、当NH3?H2O较多,滴入的 HCl较少时,生成NH4C1少量,溶液中NH3?H2O浓度远大于NH4C1浓度,可能出现.
(5)由图象可知,点d体积相同,则恰好完全反应生成NH4C1来计算;根据过量的酸进行稀释,抓住H+的物质的量不变进行计算.
| 10 -14 |
| 10 -11 |
| C(NH 4+)C(OH - ) |
| C(NH 3?H2O) |
(2)比较b、c、d三点时的溶液中溶质对水的电离平衡的影响;
(3)滴定时,由b点到c点的过程中,根据水的离子积常数、氨水的电离平衡、氯化铵的水解平衡只与温度有关来分析;
(4)A、由图象可知,点b反应后溶液是NH4C1与NH3?H2O物质的量之比为1:1的混合物,溶液呈碱性,说明NH3?H2O电离程度大于NH4C1的水解程度,由电荷守恒可知:c(C1-)+c(OH-)=c(NH4+)+c(H+),物料守恒为:2c(C1-)=c(NH4+)+c(NH3.H2O),质子守恒为:2c(OH-)+c(NH3.H2O)=c(NH4+)+2c(H+);
B、由电荷守恒可知:c(C1-)+c(OH-)=c(NH4+)+c(H+),由图象可知,点c pH=7,即c(H+)=c(OH-),故c(NH4+)=c(C1-);
C、由图象可知,点d体积相同,则恰好完全反应生成NH4C1,利用盐的水解来分析溶液呈酸性,则c(C1-)>c(NH4+)>c(H+)>c(OH-);
D、当NH3?H2O较多,滴入的 HCl较少时,生成NH4C1少量,溶液中NH3?H2O浓度远大于NH4C1浓度,可能出现.
(5)由图象可知,点d体积相同,则恰好完全反应生成NH4C1来计算;根据过量的酸进行稀释,抓住H+的物质的量不变进行计算.
解答:解:(1)氨水电离生成氢氧根离子和铵根离子,方程式为:NH3?H2O?NH4++OH-;根据滴定前氨水中C(H+)=10-11mol/L,利用水的离子积得C(OH-)=
mol/L=10-3mol/L,C(NH4+)=C(OH-)=10-3 mol/L,氨水的电离平衡常数K=
=10-5,故答案为:NH3?H2O?NH4++OH-;10-5;
(2)在b点时,溶质为氨水和氯化铵,氨水的电离程度大于氯化铵的水解程度,溶液为碱性,对水的电离平衡起到抑制作用,在c点时,溶质为氨水和氯化铵,氨水的电离程度等于于氯化铵的水解程度,溶液为中性,对水的电离平衡无影响,在d点时,溶质为氯化铵,氯化铵发生水解,溶液为酸性,对水的电离平衡促进,所以b、c、d三点时的溶液中,水电离的c(OH-)大小顺序为:d>c>b,故答案为:d>c>b;
(3)A、水的离子积常数KW=c(H+)?c(OH-),只与温度有关,所以滴定时,由b点到c点的过程中KW不变,故A正确;
B、由b点到c点的过程中,c(H+)不断增大,c(OH-)不断减小,
不断增大,故B错误;
C、氨水的电离平衡常数K=
,只与温度有关,所以滴定时,由b点到c点的过程中K不变,故C正确;
D、氯化铵的水解平衡常数K=
,只与温度有关,所以滴定时,由b点到c点的过程中K不变,故D正确;
故选:ACD.
(4)解:A、由图象可知,点b反应后溶液是NH4C1与NH3?H2O物质的量之比为1:1的混合物,溶液呈碱性,说明NH3?H2O电离程度大于NH4C1的水解程度,由电荷守恒可知:c(C1-)+c(OH-)=c(NH4+)+c(H+),物料守恒为:2c(C1-)=c(NH4+)+c(NH3.H2O),质子守恒为:2c(OH-)+c(NH3.H2O)=c(NH4+)+2c(H+);故A错误;
B、由图象可知,点c pH=7,即c(H+)=c(OH-),由电荷守恒可知:c(C1-)+c(OH-)=c(NH4+)+c(H+),故c(NH4+)=c(C1-)>c(OH-)=c(H+),故B错误;
C、由图象可知,点d 体积相同,则恰好完全反应生成NH4C1,NH4C1水解溶液呈酸性,则c(C1-)>c(NH4+)>c(H+)>c(OH-),故C错误;
D、当NH3?H2O较多,滴入的 HCl较少时,生成NH4C1少量,溶液中NH3?H2O浓度远大于NH4C1浓度,可能出现c(NH3?H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+),故D正确;
故选:D.
(5)由图象可知,点d 体积相同,则恰好完全反应生成NH4C1,由NH3?H2O~HCl得C(HCl)=
=0.1mol/L,滴定过程中所用盐酸的pH=1;
设盐酸的体积为XL,则过量的盐酸为0.1mol/L×XL-0.1Vmol/L×VL,则c(H+)=
=10-2 mol/L,解得:X=
,故答案为:1;
.
| 10 -14 |
| 10 -11 |
| 10 -3 ×10 -3 |
| 0.1 |
(2)在b点时,溶质为氨水和氯化铵,氨水的电离程度大于氯化铵的水解程度,溶液为碱性,对水的电离平衡起到抑制作用,在c点时,溶质为氨水和氯化铵,氨水的电离程度等于于氯化铵的水解程度,溶液为中性,对水的电离平衡无影响,在d点时,溶质为氯化铵,氯化铵发生水解,溶液为酸性,对水的电离平衡促进,所以b、c、d三点时的溶液中,水电离的c(OH-)大小顺序为:d>c>b,故答案为:d>c>b;
(3)A、水的离子积常数KW=c(H+)?c(OH-),只与温度有关,所以滴定时,由b点到c点的过程中KW不变,故A正确;
B、由b点到c点的过程中,c(H+)不断增大,c(OH-)不断减小,
| c(H+) |
| c(OH-) |
C、氨水的电离平衡常数K=
| c(NH4+)?c(OH-) |
| c(NH3H2O) |
D、氯化铵的水解平衡常数K=
| c(NH3H2O)?c(H+) |
| c(NH4+) |
故选:ACD.
(4)解:A、由图象可知,点b反应后溶液是NH4C1与NH3?H2O物质的量之比为1:1的混合物,溶液呈碱性,说明NH3?H2O电离程度大于NH4C1的水解程度,由电荷守恒可知:c(C1-)+c(OH-)=c(NH4+)+c(H+),物料守恒为:2c(C1-)=c(NH4+)+c(NH3.H2O),质子守恒为:2c(OH-)+c(NH3.H2O)=c(NH4+)+2c(H+);故A错误;
B、由图象可知,点c pH=7,即c(H+)=c(OH-),由电荷守恒可知:c(C1-)+c(OH-)=c(NH4+)+c(H+),故c(NH4+)=c(C1-)>c(OH-)=c(H+),故B错误;
C、由图象可知,点d 体积相同,则恰好完全反应生成NH4C1,NH4C1水解溶液呈酸性,则c(C1-)>c(NH4+)>c(H+)>c(OH-),故C错误;
D、当NH3?H2O较多,滴入的 HCl较少时,生成NH4C1少量,溶液中NH3?H2O浓度远大于NH4C1浓度,可能出现c(NH3?H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+),故D正确;
故选:D.
(5)由图象可知,点d 体积相同,则恰好完全反应生成NH4C1,由NH3?H2O~HCl得C(HCl)=
| 0.1mol/L×VL |
| VL |
设盐酸的体积为XL,则过量的盐酸为0.1mol/L×XL-0.1Vmol/L×VL,则c(H+)=
| 0.1mol/L×XL-0.1mol/L×VL |
| (X+V)L |
| 11V |
| 9 |
| 11V |
| 9 |
点评:本题以HCl溶液滴定NH3?H2ON曲线为载体,考查盐类的水解、溶液离子浓度的大小比较以及计算等,难度较大,注意离子浓度大小比较中电荷守恒、质子恒等式、物料守恒等量关系式的利用.

练习册系列答案
相关题目
常温,向浓度为0.1mol/L,体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图像回答下列问题: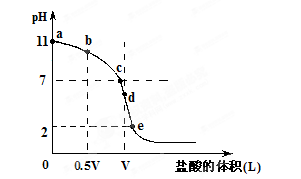
(1)氨水的电离方程式为 ,该温度时氨水的电离平衡常数K= 。
(2)比较b、c、d三点时的溶液中,水电离的c(OH-)大小顺序为 。
(3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的有 。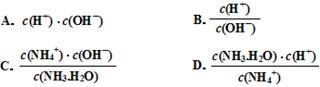
(4)根据以上滴定曲线判断下列说法正确的是(溶液中N元素只存在NH4+和NH3.H2O两种形式) 。
| A.点b所示溶液中:c(NH4+)+c(H+)=c(NH3.H2O)+c(OH-) |
| B.点c所示溶液中:c(Cl-)=c(NH3.H2O)+c(NH4+) |
| C.点d所示溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| D.滴定中可能有:c(NH3.H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
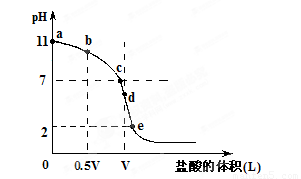
 常温,向浓度为0.1mol/L,体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题:
常温,向浓度为0.1mol/L,体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应.根据图象回答下列问题: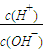 C.
C.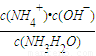 D.
D.