网址:http://m.1010jiajiao.com/timu3_id_3961868[举报]
科学家一直致力于“人工固氮”的方法研究。
(1)合成氨的原理为:N2(g)+3H2(g) 2NH3(g)ΔH="-92.4" kJ/mol,该反应的能量变化如图所示。
2NH3(g)ΔH="-92.4" kJ/mol,该反应的能量变化如图所示。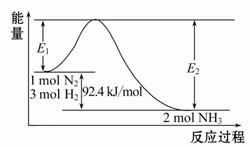
①在反应体系中加入催化剂,反应速率增大,E2的变化是 (填“增大”、“减小”或“不变”)。
②将0.3 mol N2和0.5 mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体压强变为原来的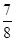 ,此时H2的转化率为 ;欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
,此时H2的转化率为 ;欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
| A.向容器中按原比例再充入原料气 |
| B.向容器中再充入一定量H2 |
| C.改变反应的催化剂 |
| D.液化生成物分离出氨 |
2N2(g)+6H2O(l)
 4NH3(g)+3O2(g)
4NH3(g)+3O2(g)ΔH="+1" 530 kJ/mol
又知:H2O(l)
 H2O(g) ΔH="+44.0" kJ/mol
H2O(g) ΔH="+44.0" kJ/mol则2N2(g)+6H2O(g)
 4NH3(g)+3O2(g) ΔH= kJ/mol,该反应的化学平衡常数表达式为K ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
查看习题详情和答案>>
4NH3(g)+3O2(g) ΔH= kJ/mol,该反应的化学平衡常数表达式为K ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
查看习题详情和答案>>
(12分)科学家一直致力于“人工固氮”的方法研究。
(1)合成氨的原理为:N2(g)+3H2(g) 2NH3(g)
2NH3(g)  H=-92.4 kJ/mol,该反应的能量变化如图所示。
H=-92.4 kJ/mol,该反应的能量变化如图所示。
①在反应体系中加入催化剂,反应速率增大,E2的变化是 (填“增大”、“减小”或“不变”)。
②将0.3 mol N2和0.5 mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体压强变为原来的 ,此时H2的转化率为 ;欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
,此时H2的转化率为 ;欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
| A.向容器中按原比例再充入原料气 | B.向容器中再充入一定量H2 |
| C.改变反应的催化剂 | D.液化生成物分离出氨 |
2N2(g)+6H2O(1)
 4NH3(g)+3O2(g)
4NH3(g)+3O2(g)  H="+1530" kJ/mol
H="+1530" kJ/mol又知:H2O(1)=H2O(g)
 H=+44.0 kJ/mol
H=+44.0 kJ/mol则2N2(g)+6H20(g)
 4NH3(g)+302(g)
4NH3(g)+302(g)  H = kJ/mol,该反应的化学平衡常数表达式为K= ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
查看习题详情和答案>>
H = kJ/mol,该反应的化学平衡常数表达式为K= ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
查看习题详情和答案>>
温室气体二氧化碳减排的一种方法是:从燃煤电厂或天然气电厂排放气中回收CO2,再与CH4热解炉产生的H2反应生成CH3OH.
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
(1)500℃时,
在体积为1 L的容积固定的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=________mol·L-1·min-1.
②该反应的平衡常数K=________(保留一位小数),平衡时H2的转化率为________.
③已知温度升高,K值减小.下列措施中能使n(CH3OH)/n(CO2)增大的是________.
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离
D.再充入1 mol CO2和3 mol H2
(2)CH3OH作为内燃机燃料或通过燃料电池驱动车辆.可减少CO2排放多达45%.
①已知:CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) ΔH1=+49.0 kJ·mol-1
CO2(g)+3H2(g) ΔH1=+49.0 kJ·mol-1
2H2(g)+O2(g)![]() 2H2O(g) ΔH=-483.6 kJ·mol-1
2H2O(g) ΔH=-483.6 kJ·mol-1
则反应
CH3OH(g)+②
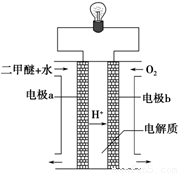
甲醇质子交换膜燃料电池的结构示意图如下,已知H+移向通入O2的电极,甲醇进入________极(填“正”或“负”),正极发生的电极反应为________.
过度排放CO2会造成“温室效应”,为了减少煤燃烧对环境造成的污染,煤的气化是高效、清洁利用煤炭的重要途径。煤综合利用的一种途径如图所示。

(1)已知①C(s) + H2O(g) = CO(g)+H2(g) ΔH1=+131.3 kJ·mol-1
②C(s) + 2H2O(g) = CO2(g) + 2H2(g) ΔH2=+90 kJ·mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是 ________________________,
(2)用下图原电池装置可以完成过程⑤的转化,该装置b电极的电极反应式是_______________________。

(3)在压强为0.1 MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇:
CO(g)+2H2(g)  CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:

①p1________p2(填“>”、“<”或“=”)。
②在其他条件不变的情况下,向容器中再增加a mol CO与2a mol H2,达到新平衡时,CO的平衡转化率________(填“增大”、“减小”或“不变”)。
③在p1下,100 ℃时,CO(g)+2H2(g)
 CH3OH(g)反应的平衡常数为________(用含a、V的代数式表示)。
CH3OH(g)反应的平衡常数为________(用含a、V的代数式表示)。
(4)如图表示CO2与H2反应生成CH3OH和H2O的过程中能量(单位为kJ·mol-1)的变化:

关于该反应的下列说法中,正确的是________(填编号)。
A.ΔH>0,ΔS>0 B.ΔH>0,ΔS<0
C.ΔH<0,ΔS<0 D.ΔH<0,ΔS>0
(5)为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1 mol
CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化的曲线如图所示:
CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化的曲线如图所示:

①从反应开始到平衡,CO2的平均反应速率v(CO2)=________。
②下列措施中能使化学平衡向正反应方向移动的是________(填编号)。
A.升高温度 B.将CH3OH(g)及时液化移出
C.选择高效催化剂 D.再充入1 mol CO2和3 mol H2
查看习题详情和答案>>
过度排放CO2会造成“温室效应”,为了减少煤燃烧对环境造成的污染,煤的气化是高效、清洁利用煤炭的重要途径。煤综合利用的一种途径如图所示。
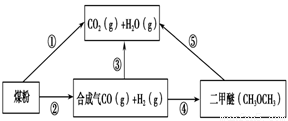
(1)已知①C(s) + H2O(g) = CO(g)+H2(g) ΔH1=+131.3 kJ·mol-1
②C(s) + 2H2O(g) = CO2(g) + 2H2(g) ΔH2=+90 kJ·mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是 ________________________,
(2)用下图原电池装置可以完成过程⑤的转化,该装置b电极的电极反应式是_______________________。
(3)在压强为0.1 MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇:
CO(g)+2H2(g)  CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:

①p1________p2(填“>”、“<”或“=”)。
②在其他条件不变的情况下,向容器中再增加a mol CO与2a mol H2,达到新平衡时,CO的平衡转化率________(填“增大”、“减小”或“不变”)。
③在p1下,100 ℃时,CO(g)+2H2(g)
 CH3OH(g)反应的平衡常数为________(用含a、V的代数式表示)。
CH3OH(g)反应的平衡常数为________(用含a、V的代数式表示)。
(4)如图表示CO2与H2反应生成CH3OH和H2O的过程中能量(单位为kJ·mol-1)的变化:
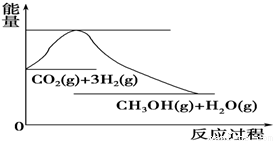
关于该反应的下列说法中,正确的是________(填编号)。
A.ΔH>0,ΔS>0 B.ΔH>0,ΔS<0
C.ΔH<0,ΔS<0 D.ΔH<0,ΔS>0
(5)为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1 mol
CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化的曲线如图所示:
CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化的曲线如图所示:

①从反应开始到平衡,CO2的平均反应速率v(CO2)=________。
②下列措施中能使化学平衡向正反应方向移动的是________(填编号)。
A.升高温度 B.将CH3OH(g)及时液化移出
C.选择高效催化剂 D.再充入1 mol CO2和3 mol H2
查看习题详情和答案>>