题目内容
离子反应是中学化学中重要的反应类型.回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
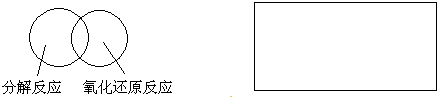
(2)可用图示的方法表示不同反应类型之间的关系.如分解反应和氧化还原反应可表示为下图.请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系.

(3)离子方程式是中学生应熟练掌握的化学用语,请写出下列反应的离子方程式:
向Ba(HCO3)2溶液中滴入NaHSO4溶液,至沉淀完全,反应的离子方程式
在上述溶液中继续滴入NaHSO4溶液,此时离子方程式为
(1)在发生离子反应的反应物或生成物中,一定存在
③⑤
③⑤
.①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)可用图示的方法表示不同反应类型之间的关系.如分解反应和氧化还原反应可表示为下图.请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系.

(3)离子方程式是中学生应熟练掌握的化学用语,请写出下列反应的离子方程式:
向Ba(HCO3)2溶液中滴入NaHSO4溶液,至沉淀完全,反应的离子方程式
Ba2++SO42-+H++HCO3-═BaSO4+H2O+CO2↑
Ba2++SO42-+H++HCO3-═BaSO4+H2O+CO2↑
.在上述溶液中继续滴入NaHSO4溶液,此时离子方程式为
H++HCO3-═H2O+CO2↑
H++HCO3-═H2O+CO2↑
.分析:(1)离子反应是由离子参加的反应,化合物在一定的条件下电离出能反应的离子;
(2)置换反应都是氧化还原反应,离子反应部分是氧化还原反应,部分是非氧化还原反应,置换反应部分是离子反应,部分不是离子反应;
(3)向Ba(HCO3)2溶液中滴入NaHSO4,至沉淀完全,硫酸氢钠的量少,碳酸氢钡有剩余,继续加硫酸氢钠,电离出的氢离子可以将多余的碳酸氢根离子反应掉.
(2)置换反应都是氧化还原反应,离子反应部分是氧化还原反应,部分是非氧化还原反应,置换反应部分是离子反应,部分不是离子反应;
(3)向Ba(HCO3)2溶液中滴入NaHSO4,至沉淀完全,硫酸氢钠的量少,碳酸氢钡有剩余,继续加硫酸氢钠,电离出的氢离子可以将多余的碳酸氢根离子反应掉.
解答:解:(1)离子反应是由离子参加的反应,发生的条件是化合物在一定的条件下必须电离出能反应的离子,
故答案为:③⑤;
(2)置换反应都是氧化还原反应,离子反应部分是氧化还原反应,部分是非氧化还原反应,置换反应部分是离子反应,部分不是离子反应,其关系如图所示: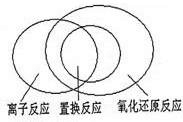 ,
,
故答案为: ;
;
(3)向Ba(HCO3)2溶液中滴入NaHSO4,至沉淀完全的过程中,硫酸氢钠的量相对于Ba(HCO3)2溶液不足,所以碳酸氢钡有剩余,硫酸氢钠全反应,氢离子和硫酸根之间的物质的量之比是1:1,即发生反应:Ba2++SO42-+H++HCO3-═BaSO4+H2O+CO2↑;继续加硫酸氢钠,它电离出的氢离子又可以将多余的碳酸氢根离子反应掉,即H++HCO3-═H2O+CO2↑,
故答案为:Ba2++SO42-+H++HCO3-═BaSO4+H2O+CO2↑;H++HCO3-═H2O+CO2↑.
故答案为:③⑤;
(2)置换反应都是氧化还原反应,离子反应部分是氧化还原反应,部分是非氧化还原反应,置换反应部分是离子反应,部分不是离子反应,其关系如图所示:
 ,
,故答案为:
 ;
;(3)向Ba(HCO3)2溶液中滴入NaHSO4,至沉淀完全的过程中,硫酸氢钠的量相对于Ba(HCO3)2溶液不足,所以碳酸氢钡有剩余,硫酸氢钠全反应,氢离子和硫酸根之间的物质的量之比是1:1,即发生反应:Ba2++SO42-+H++HCO3-═BaSO4+H2O+CO2↑;继续加硫酸氢钠,它电离出的氢离子又可以将多余的碳酸氢根离子反应掉,即H++HCO3-═H2O+CO2↑,
故答案为:Ba2++SO42-+H++HCO3-═BaSO4+H2O+CO2↑;H++HCO3-═H2O+CO2↑.
点评:本题是对离子反应和离子共存知识的考查,题目综合性较强,难度不大.

练习册系列答案
相关题目