摘要:在稀硫酸中.KMnO4和H2O2能发生氧化还原反应生成MnSO4.K2SO4.H2O和O2 (1)写出该氧化还原反应的化学方程式: . (2)反应中氧化剂是 ,被氧化的元素是 ,若有0.5 mol H2O2参加此反应.电子转移个数为 . (3)若KMnO4的量不足.在Mn2+的催化作用下.H2O2仍能分解.分解反应的化学方程式为: ,这时若有0.5 mol H2O2发生分解.电子转移个数为 .
网址:http://m.1010jiajiao.com/timu3_id_395721[举报]
在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:
氧化反应:H2O2-2e-═2H++O2↑
还原反应:Mn
+5e-+8H+═Mn2++4H2O
(1)写出该氧化还原反应的离子方程式:
(2)该反应中氧化剂是
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为
查看习题详情和答案>>
氧化反应:H2O2-2e-═2H++O2↑
还原反应:Mn
| O | - 4 |
(1)写出该氧化还原反应的离子方程式:
5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O
5H2O2+2MnO4-+6H+=2Mn2++5O2↑+8H2O
.(2)该反应中氧化剂是
KMnO4
KMnO4
,被氧化的元素是氧
氧
;若有0.5mol H2O2参加此反应,则转移电子个数为6.02×1023
6.02×1023
.(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
;这时若有0.5mol H2O2发生分解,则转移电子个数为
| ||
3.01×1023
3.01×1023
.(12分)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:
氧化反应:H2O2 – 2e- = 2H+ + O2↑ 还原反应:MnO4- + 5e- + 8H+ = Mn2+ + 4H2O
(1)写出该氧化还原反应的离子方程式: 。
(2)反应中氧化剂是 ;氧化产物是 ;若有0.5molH2O2参加此反应,电子一转移个数为 。
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为 ;这时若有0.5molH2O2发生分解,电子转移个数为 。
(12分)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:
氧化反应:H2O2 – 2e- = 2H+ + O2↑ 还原反应:MnO4- + 5e- + 8H+ = Mn2+ + 4H2O
(1)写出该氧化还原反应的离子方程式: 。
(2)反应中氧化剂是 ;氧化产物是 ;若有0.5molH2O2参加此反应,电子一转移个数为 。
(3)若KMnO4的量不足,在Mn2+的催化作用下,H2O2仍能分解,分解反应的化学方程式为 ;这时若有0.5molH2O2发生分解,电子转移个数为 。
查看习题详情和答案>>
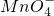 +5e-+8H+═Mn2++4H2O
+5e-+8H+═Mn2++4H2O