摘要:族序数等于周期数2倍的元素是C.S.
网址:http://m.1010jiajiao.com/timu3_id_39550[举报]
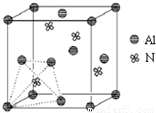
元素周期表中的第ⅢA、ⅣA、ⅤA族的部分元素往往易形成原子晶体,氮化铝、磷化硼和砷化镓属于此列,如氮化铝晶体中每个Al原子与4个N原子相连,每个N原子也与4个Al原子相连,晶胞如右图所示.磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层;砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%.试回答下列问题:
(1)下列离子中最外层电子数不为8的是______(选填序号).
A.P3- B.Al3+ C.Ti4+ D.Ga3+
(2)下列说法正确的是______(选填序号).
A.硼和镓都属于S区元素,磷、砷属于P区元素
B.第一电离能:As>Ga Mg>Al
C.根据等电子体原理,砷化镓、磷化硼的晶胞与氮化铝晶体相同且类似于单晶硅
D.NH3沸点高于AsH3,其原因是NH3分子中共价键强度较大
(3)砷化镓可由(CH3)3Ga和AsH3反应得到,该反应在700℃进行,反应的化学方程式为______;
下列有机分子中碳原子的杂化方式与(CH3)3Ga分子中Ga原子的杂化方式相同的是______.(填序号)
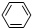
A.CH4B.CH2=CH2C.CH≡CH D.HCHO E.
(4)请画出三溴化磷分子的路易斯结构式______,请判断三溴化硼分子属于______(填“极性”“非极性”)分子.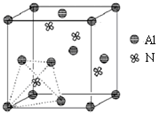
查看习题详情和答案>>
(1)下列离子中最外层电子数不为8的是______(选填序号).
A.P3- B.Al3+ C.Ti4+ D.Ga3+
(2)下列说法正确的是______(选填序号).
A.硼和镓都属于S区元素,磷、砷属于P区元素
B.第一电离能:As>Ga Mg>Al
C.根据等电子体原理,砷化镓、磷化硼的晶胞与氮化铝晶体相同且类似于单晶硅
D.NH3沸点高于AsH3,其原因是NH3分子中共价键强度较大
(3)砷化镓可由(CH3)3Ga和AsH3反应得到,该反应在700℃进行,反应的化学方程式为______;
下列有机分子中碳原子的杂化方式与(CH3)3Ga分子中Ga原子的杂化方式相同的是______.(填序号)
A.CH4B.CH2=CH2C.CH≡CH D.HCHO E.

(4)请画出三溴化磷分子的路易斯结构式______,请判断三溴化硼分子属于______(填“极性”“非极性”)分子.

元素周期表中的第ⅢA、ⅣA、ⅤA族的部分元素往往易形成原子晶体,氮化铝、磷化硼和砷化镓属于此列,如氮化铝晶体中每个Al原子与4个N原子相连,每个N原子也与4个Al原子相连,晶胞如右图所示.磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层;砷化镓属于第三代半导体,它能直接将电能转变为光能,砷化镓灯泡寿命是普通灯泡的100倍,而耗能只有其10%.试回答下列问题:
(1)下列离子中最外层电子数不为8的是______(选填序号).
A.P3- B.Al3+ C.Ti4+ D.Ga3+
(2)下列说法正确的是______(选填序号).
A.硼和镓都属于S区元素,磷、砷属于P区元素
B.第一电离能:As>Ga Mg>Al
C.根据等电子体原理,砷化镓、磷化硼的晶胞与氮化铝晶体相同且类似于单晶硅
D.NH3沸点高于AsH3,其原因是NH3分子中共价键强度较大
(3)砷化镓可由(CH3)3Ga和AsH3反应得到,该反应在700℃进行,反应的化学方程式为______
 查看习题详情和答案>>
查看习题详情和答案>>
(1)下列离子中最外层电子数不为8的是______(选填序号).
A.P3- B.Al3+ C.Ti4+ D.Ga3+
(2)下列说法正确的是______(选填序号).
A.硼和镓都属于S区元素,磷、砷属于P区元素
B.第一电离能:As>Ga Mg>Al
C.根据等电子体原理,砷化镓、磷化硼的晶胞与氮化铝晶体相同且类似于单晶硅
D.NH3沸点高于AsH3,其原因是NH3分子中共价键强度较大
(3)砷化镓可由(CH3)3Ga和AsH3反应得到,该反应在700℃进行,反应的化学方程式为______
 查看习题详情和答案>>
查看习题详情和答案>>
短周期元素A、B、C、D、E原子序数依次递增,A原子最外层电子数是次外层电子数的2倍,B的单质为双原子分子,其氢化物能使湿润的石蕊试纸变蓝,C在同周期元素中原子半径最大,D的最外层电子数等于电子层数,E的最高正价是+7价.
(1)写出E元素在周期表中的位置
(2)写出A元素气态氢化物的结构式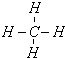
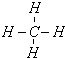
(3)B的氢化物和E的氢化物反应所得生成物的电子式为
 .
.
(4)D单质和C的最高价氧化物对应的水化物的溶液反应的离子方程式为
(5)A单质与B的最高价氧化物对应的水化物的浓溶液反应的化学方程式为
查看习题详情和答案>>
(1)写出E元素在周期表中的位置
第三周期第VIIA族
第三周期第VIIA族
(2)写出A元素气态氢化物的结构式
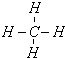
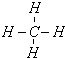
(3)B的氢化物和E的氢化物反应所得生成物的电子式为


(4)D单质和C的最高价氧化物对应的水化物的溶液反应的离子方程式为
2Al+2OH-+2H2O═2AlO2-+3H2↑
2Al+2OH-+2H2O═2AlO2-+3H2↑
(5)A单质与B的最高价氧化物对应的水化物的浓溶液反应的化学方程式为
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
| ||
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
.
| ||
短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原子核外电子层数之和为13.已知B元素形成的化合物种类最多,D元素原子最外层电子数是次外层电子数的3倍,元素E的原子半径在同周期中最大,F元素原子最外层电子数等于其电子层数.
(1)C元素在元素周期表中的位置是
(2)由A、B、D、E四种元素形成的化合物中所含的化学键类型是
(3)写出E2D2与A2D反应的离子方程式
(4)实验室配制100mL0.2mol?L-1由A、D、E形成化合物的溶液,需要用到的玻璃仪器除烧杯、小烧杯外还有
查看习题详情和答案>>
(1)C元素在元素周期表中的位置是
第二周期第ⅤA族
第二周期第ⅤA族
,B的单质与C的最高价氧化物对应水化物的浓溶液发生反应的化学方程式是C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
| ||
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
| ||
(2)由A、B、D、E四种元素形成的化合物中所含的化学键类型是
离子键、共价键
离子键、共价键
(3)写出E2D2与A2D反应的离子方程式
2Na2O2+2H2O=4Na++4OH-+O2↑
2Na2O2+2H2O=4Na++4OH-+O2↑
.(4)实验室配制100mL0.2mol?L-1由A、D、E形成化合物的溶液,需要用到的玻璃仪器除烧杯、小烧杯外还有
100mL容量瓶、玻璃棒、胶头滴管
100mL容量瓶、玻璃棒、胶头滴管
;如果定容时仰视刻度线,则所配制溶液浓度<
<
0.2mol?L-1(埴“>”、“<”或“=”).将F的单质溶于上述配制的溶液中所发生反应的离子方程式是2Al+2OH-+2H2O=+2AlO2-+3H2↑
2Al+2OH-+2H2O=+2AlO2-+3H2↑
.短周期元素A、B、C、D原子序数依次增大,且只有C为金属元素.A、C位于同一主族,B的最外层电子数为次外层的3倍,B、C的最外层电子灵敏之和与D的最外层电子数相等.请回答下列问题:
(1)D的最高价氧化物对应水化物名称为
(2)C2B2的电子式为
 ,其中含有的化学键类型为
,其中含有的化学键类型为
(3)由上述四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分.将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应离子方程式为
(4)用石墨电极电解CD的饱和溶液,反应的离子方程式为
若反应后溶液的体积为200mL,测得pH为13,则阳极得到的气体质量为
(5)实验室欲检验CD溶液中所含的D-,操作方法和现象为
查看习题详情和答案>>
(1)D的最高价氧化物对应水化物名称为
高氯酸
高氯酸
.(2)C2B2的电子式为


离子键、非极性键
离子键、非极性键
.(3)由上述四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分.将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应离子方程式为
2I-+ClO-+H2O=I2+Cl-+2OH-
2I-+ClO-+H2O=I2+Cl-+2OH-
(4)用石墨电极电解CD的饱和溶液,反应的离子方程式为
2NaCl+2H2O
Cl2↑+H2↑+2NaOH
| ||
2NaCl+2H2O
Cl2↑+H2↑+2NaOH
,
| ||
若反应后溶液的体积为200mL,测得pH为13,则阳极得到的气体质量为
0.71g
0.71g
,外电路中通过的物质的量为0.02mol
0.02mol
(5)实验室欲检验CD溶液中所含的D-,操作方法和现象为
取少许试液,向其中加入硝酸酸化的硝酸银溶液,若有白色沉淀产生,则证明有Cl-
取少许试液,向其中加入硝酸酸化的硝酸银溶液,若有白色沉淀产生,则证明有Cl-
.