网址:http://m.1010jiajiao.com/timu3_id_394941[举报]
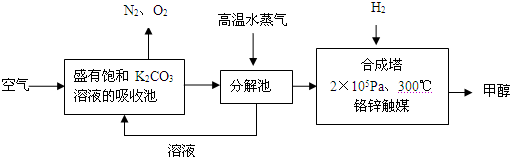
试回答下列问题:
(1)写出分解池中发生反应的化学方程式
| ||
| ||
(2)在2×105Pa、300℃合成塔中,若有CO2与H2反应生成32g甲醇和水,放出49.5kJ的热量,试写出合成塔中发生反应的热化学方程式:
(3)在合成塔中发生的是放热反应,高温不利于甲醇的生成,合成塔中维持300℃的较高温度的原因可能是
(4)甲醇的一个重要作用是制燃料电池,常用KOH作电解质溶液,负极的电极反应式为:
(5)常温常压下,饱和CO2水溶液的pH=5.6,c (H2CO3)=1.5×10-5mol?L-1,若忽略水的电离和H2CO3的二级电离,则H2CO3?HCO3-+H+的平衡常数K=
(6)某同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积常数分别为4.96×10-9、2.58×10-9,该同学应该选用较合适的试剂是
A.Ba(OH)2溶液 B.Ca(OH)2溶液
C.BaCl2和NaOH混合溶液 D.CaCl2溶液.
SO2是大气污染物之一,为粗略地测定周围环境中SO2的含量,某学生课外活动小组设计了如下图所示实验装置。

(1).检查该装置的气密性时,先在试管中装入适量的水(保证玻璃导管的下端浸没在水中),然后_______________________________________(填写操作方法)时,将会看到________________(填写实验现象),则证明该装置的气密性良好( )
A.向外轻轻拉动注射器的活塞 浸没在水中的玻璃导管口有气泡冒出
B.向内轻轻推动注射器的活塞 浸没在水中的玻璃导管口有气泡冒出
C.向外轻轻拉动注射器的活塞 浸没在水中的玻璃导管口有水柱上升
D.手握试管 浸没在水中的玻璃导管口有气泡冒出
(2).向试管中加入0.000 5 mol/L碘水1.0 mL,用适量的蒸馏水稀释后再加入2~3滴淀粉溶液,配制成溶液A。测定指定地点的空气中SO2的含量时,推拉注射器的活塞反复抽气,A溶液由________色变成______色时反应恰好完全进行,此时停止抽气( )
A.红 无 B.无 红 C.蓝 无 D.无 蓝
(3).我国环境空气质量标准中对每次空气质量测定中SO2的最高浓度限值如下表:
|
浓度限值/mg/m3 |
||
|
一级标准 |
二极标准 |
三级标准 |
|
0.15 |
0.50 |
0.70 |
该学生课外活动小组分成第一小组和第二小组,使用相同的实验装置和溶液A。在同一地点、同时测量空气中SO2的含量。反应恰好完全进行,记录抽气次数和结果如下(假设每次抽气500 mL)。
|
分组 |
第一小组 |
第二小组 |
|
抽气次数 |
100 |
120 |
|
SO2含量/mg/m3 |
0.64 |
0.53 |
____小组的测定结果正确( )
A.第一 B.第二
C.都正确 D.都不正确
(4).判断该地点的空气中SO2的含量属于________标准( )
A.一级 B.二级 C.三级 D.四级
(5).实验结果产生较大偏差的原因是(所用装置和药品均无问题)( )
A.抽气速度过快,造成空气中SO2无法与碘水充分反应,产生较大的误差
B.抽气速度过慢,造成空气中SO2无法与碘水充分反应,产生较大的误差
C.装置漏气,造成空气中SO2无法与碘水充分反应,产生较大的误差
D.抽气速度过快,造成空气中O2与碘水充分反应,产生较大的误差
查看习题详情和答案>>
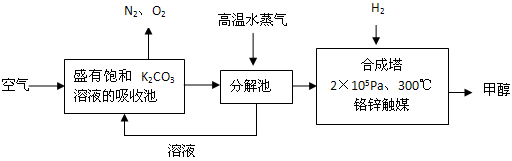
(1)写出分解池中发生反应的化学方程式_________________________。
(2)在2×105Pa、300℃合成塔中,若有CO2与H2反应生成32g甲醇和水,放出49.5kJ的热量,试写出合成塔中发生反应的热化学方程式: ______________________。
(3)在合成塔中发生的是放热反应,高温不利于甲醇的生成,合成塔中维持300℃的较高温度的原因可能是_______________;若要提高甲醇的产率,可采取的措施有(写2条):________________ 、______________。
(4)甲醇的一个重要作用是制燃料电池,常用KOH作电解质溶液,负极的电极反应式为:_____________________。
(5)常温常压下,饱和CO2水溶液的的pH=5.6,c (H2CO3)= 1.5×10–5mol/L,若忽略水的电离和H2CO3的二级电离,则H2CO3
 HCO3–+ H+的平衡常数K= _________ (计算结果保留2位有效数字,己知10–5.6=2.5×10–6)。
HCO3–+ H+的平衡常数K= _________ (计算结果保留2位有效数字,己知10–5.6=2.5×10–6)。 (6)某同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积常数分别为4.96×10–9、2.58×10–9,该同学应该选用较合适的试剂是_________(填字母)。
A.Ba(OH)2溶液
B.Ca(OH)2溶液
C.BaCl2和NaOH混合溶液
D.CaCl2溶液
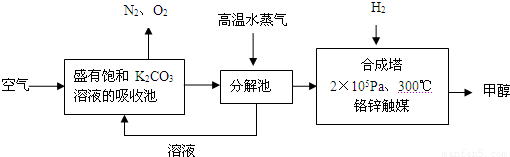
试回答下列问题:
(1)写出分解池中发生反应的化学方程式 .
(2)在2×105Pa、300℃合成塔中,若有CO2与H2反应生成32g甲醇和水,放出49.5kJ的热量,试写出合成塔中发生反应的热化学方程式: _ .
(3)在合成塔中发生的是放热反应,高温不利于甲醇的生成,合成塔中维持300℃的较高温度的原因可能是 ;若要提高甲醇的产率,可采取的措施有(写2条): 、 .
(4)甲醇的一个重要作用是制燃料电池,常用KOH作电解质溶液,负极的电极反应式为: .
(5)常温常压下,饱和CO2水溶液的pH=5.6,c (H2CO3)=1.5×10-5mol?L-1,若忽略水的电离和H2CO3的二级电离,则H2CO3?HCO3-+H+的平衡常数K= (计算结果保留2位有效数字,己知10-5.6=2.5×10-6).
(6)某同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积常数分别为4.96×10-9、2.58×10-9,该同学应该选用较合适的试剂是 (填字母).
A.Ba(OH)2溶液 B.Ca(OH)2溶液
C.BaCl2和NaOH混合溶液 D.CaCl2溶液. 查看习题详情和答案>>
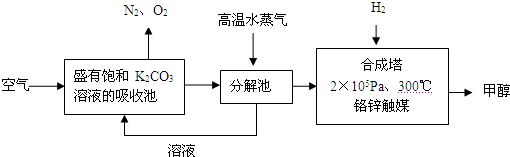
试回答下列问题:
(1)写出分解池中发生反应的化学方程式______.
(2)在2×105Pa、300℃合成塔中,若有CO2与H2反应生成32g甲醇和水,放出49.5kJ的热量,试写出合成塔中发生反应的热化学方程式:_____________.
(3)在合成塔中发生的是放热反应,高温不利于甲醇的生成,合成塔中维持300℃的较高温度的原因可能是______;若要提高甲醇的产率,可采取的措施有(写2条):______、______.
(4)甲醇的一个重要作用是制燃料电池,常用KOH作电解质溶液,负极的电极反应式为:______.
(5)常温常压下,饱和CO2水溶液的pH=5.6,c (H2CO3)=1.5×10-5mol?L-1,若忽略水的电离和H2CO3的二级电离,则H2CO3?HCO3-+H+的平衡常数K=______(计算结果保留2位有效数字,己知10-5.6=2.5×10-6).
(6)某同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积常数分别为4.96×10-9、2.58×10-9,该同学应该选用较合适的试剂是______(填字母).
A.Ba(OH)2溶液 B.Ca(OH)2溶液
C.BaCl2和NaOH混合溶液 D.CaCl2溶液.