摘要:51].说出活化分子与普通分子的区别.
网址:http://m.1010jiajiao.com/timu3_id_394928[举报]
工业生产苯乙烯是利用乙苯的脱氢反应:

下列说法错误的是( )

下列说法错误的是( )
| A、该反应中生成物的总能量高于反应物 | B、增大压强反应物活化分子百分数不变 | C、升高温度可以提高原料乙苯的转化率 | D、不断分离出苯乙烯可加快反应速率 |
二甲基亚砜有消炎止痛、镇静等作用.甲醇和硫化氢在γ-Al2O3催化剂作用下生成甲硫(CH3-S-CH3),甲硫醚再与NO2反应制取二甲基亚砜( ),有关反应如下:
),有关反应如下:
反应①2CH3OH(l)+H2S(g)=(CH3)2S(l)+2H2O(l)△H=-akJ?mol-1
反应②(CH3)2S(l)+NO2(g)=(CH3)2SO(l)+NO(g)△H=-bkJ??mol-1
反应③2NO(g)+O2(g)=2NO2(g)△H=-ckJ?mol-1
(1)写出用甲硫醚直接和氧气反应制取二甲基亚砜的热化学反应方程式
(2)能说明反应2CH3OH(l)+H2S(g)?(CH3)2S(l)+2H2O(l)达平衡状态的是
A.v(CH3OH)=2v(H2S)
B.恒容容器中,体系的压强不再改变
C.恒容容器中,体系中气体的密度不再改变
D.恒容容器中,气体的摩尔质量不再改变
(3)反应③在一定条件下可达到平衡,则此条件下该反应平衡常数表达式K=
.

(4)上图是反应③在一定条件下发生反应,反应物和生成物能量与活化能的关系.在图中曲线
(5)N2O5是一种新型绿色硝化剂,其制备方法有以下两种.
方法一:4NO2(g)+O2(g)=2N2O5(g);△H=-56.76KJ?mol-1
常温下,该反应能逆向自发进行,则逆向反应的△S
方法二:用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5.工作原理如图:

硼氢化钠燃料电池的正极反应式
查看习题详情和答案>>
 ),有关反应如下:
),有关反应如下:反应①2CH3OH(l)+H2S(g)=(CH3)2S(l)+2H2O(l)△H=-akJ?mol-1
反应②(CH3)2S(l)+NO2(g)=(CH3)2SO(l)+NO(g)△H=-bkJ??mol-1
反应③2NO(g)+O2(g)=2NO2(g)△H=-ckJ?mol-1
(1)写出用甲硫醚直接和氧气反应制取二甲基亚砜的热化学反应方程式
2(CH3)2S(l)+O2(g)=2(CH3)2SO(l)△H=-(2b+c)kJ?mol-1
2(CH3)2S(l)+O2(g)=2(CH3)2SO(l)△H=-(2b+c)kJ?mol-1
,(2)能说明反应2CH3OH(l)+H2S(g)?(CH3)2S(l)+2H2O(l)达平衡状态的是
BC
BC
.A.v(CH3OH)=2v(H2S)
B.恒容容器中,体系的压强不再改变
C.恒容容器中,体系中气体的密度不再改变
D.恒容容器中,气体的摩尔质量不再改变
(3)反应③在一定条件下可达到平衡,则此条件下该反应平衡常数表达式K=
| c2(NO2) |
| C2(NO)c(O2) |
| c2(NO2) |
| C2(NO)c(O2) |

(4)上图是反应③在一定条件下发生反应,反应物和生成物能量与活化能的关系.在图中曲线
b
b
(填“a”或“b”)表示加入催化剂的能量变化曲线,催化剂能加快反应速率的原理是催化剂能降低该反应的活化能,提高活化分子的百分数,化学反应速率加快
催化剂能降低该反应的活化能,提高活化分子的百分数,化学反应速率加快
;(5)N2O5是一种新型绿色硝化剂,其制备方法有以下两种.
方法一:4NO2(g)+O2(g)=2N2O5(g);△H=-56.76KJ?mol-1
常温下,该反应能逆向自发进行,则逆向反应的△S
>
>
0(填“>、<”或“=”)方法二:用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5.工作原理如图:

硼氢化钠燃料电池的正极反应式
H2O2+2e-=2OH-
H2O2+2e-=2OH-
.图表法、图象法是常用的科学研究方法.
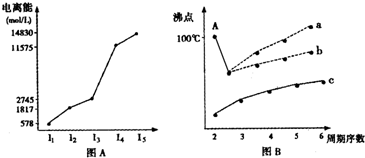
(1)I.短周期某主族元素M的电离能情况如图(A)所示.则M元素位于周期表的第
II.图B是研究部分元素的氢化物的沸点变化规律的图象,折线c可以表达出第
(2)部分有机物的熔沸点见下表:
由这些数据你能得出的结论是(至少写2条):
查看习题详情和答案>>

(1)I.短周期某主族元素M的电离能情况如图(A)所示.则M元素位于周期表的第
IIIA
IIIA
族.II.图B是研究部分元素的氢化物的沸点变化规律的图象,折线c可以表达出第
IVA
IVA
族元素氢化物的沸点的变化规律.不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线--折线a和折线b,你认为正确的是a还是b?并说出理由:b;A点所示的氢化物是水,由于在水分子间存在氢键,所以其沸点高于氧族元素中的其它氢化物的沸点
b;A点所示的氢化物是水,由于在水分子间存在氢键,所以其沸点高于氧族元素中的其它氢化物的沸点
.(2)部分有机物的熔沸点见下表:
| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 |  |
 |
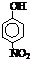 |
| 沸点/℃ | -164 | -88.6 | -0.5 | 熔点/℃ | 45 | 96 | 114 |
同系物相对分子质量越大、分子间作用力越强,故沸点越高
同系物相对分子质量越大、分子间作用力越强,故沸点越高
,当有机能形成分子内氢键时,分子间作用力减弱,熔点变低(当分子间能形成氢键时,分子间作用力增强,熔点升高)
当有机能形成分子内氢键时,分子间作用力减弱,熔点变低(当分子间能形成氢键时,分子间作用力增强,熔点升高)
.有A、B、C、D、E五种元素,其中A、B、C、D为短周期元素,A元素的周期数、主族数、原子序数相同;B原子核外有3种能量不同的原子轨道且每种轨道中的电子数相同;C原子的价电子构型为csccpc+1,D元素的原子最外层电子数比次外层电子数少2个,D的阴离子与E的阳离子电子层结构相同,D和E可形成化合物E2D.
(1)上述元素中,第一电离能最小的元素的原子结构示意图为 ;D的价电子排布式图为 ;
(2)下列分子结构图中的●和○表示上述元素的原子中除去最外层电子的剩余部分,小黑点表示没有形成共价键的最外层电子,短线表示共价键.
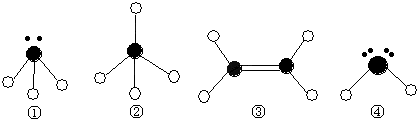
则在以上分子中,中心原子采用sp3杂化形成化学键的是 (填写分子的化学式); 在③的分子中有 个σ键和 个π键.
(3)A、C、D可形成既具有离子键又具有共价键的化合物,其化学式可能为 ;足量的C的氢化物水溶液与CuSO4 溶液反应生成的配合物,其化学式为 ,请说出该配合物中中心原子与配位体及内界与外界之间的成键情况: .
查看习题详情和答案>>
(1)上述元素中,第一电离能最小的元素的原子结构示意图为
(2)下列分子结构图中的●和○表示上述元素的原子中除去最外层电子的剩余部分,小黑点表示没有形成共价键的最外层电子,短线表示共价键.

则在以上分子中,中心原子采用sp3杂化形成化学键的是
(3)A、C、D可形成既具有离子键又具有共价键的化合物,其化学式可能为