题目内容
图表法、图象法是常用的科学研究方法.
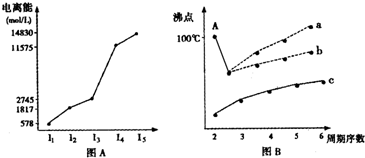
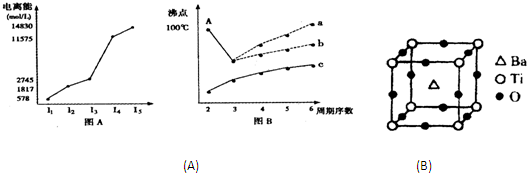
(1)I.短周期某主族元素M的电离能情况如图(A)所示.则M元素位于周期表的第
II.图B是研究部分元素的氢化物的沸点变化规律的图象,折线c可以表达出第
(2)部分有机物的熔沸点见下表:
由这些数据你能得出的结论是(至少写2条):

(1)I.短周期某主族元素M的电离能情况如图(A)所示.则M元素位于周期表的第
IIIA
IIIA
族.II.图B是研究部分元素的氢化物的沸点变化规律的图象,折线c可以表达出第
IVA
IVA
族元素氢化物的沸点的变化规律.不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线--折线a和折线b,你认为正确的是a还是b?并说出理由:b;A点所示的氢化物是水,由于在水分子间存在氢键,所以其沸点高于氧族元素中的其它氢化物的沸点
b;A点所示的氢化物是水,由于在水分子间存在氢键,所以其沸点高于氧族元素中的其它氢化物的沸点
.(2)部分有机物的熔沸点见下表:
| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 |  |
 |
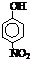 |
| 沸点/℃ | -164 | -88.6 | -0.5 | 熔点/℃ | 45 | 96 | 114 |
同系物相对分子质量越大、分子间作用力越强,故沸点越高
同系物相对分子质量越大、分子间作用力越强,故沸点越高
,当有机能形成分子内氢键时,分子间作用力减弱,熔点变低(当分子间能形成氢键时,分子间作用力增强,熔点升高)
当有机能形成分子内氢键时,分子间作用力减弱,熔点变低(当分子间能形成氢键时,分子间作用力增强,熔点升高)
.分析:(1)电离能是元素的原子失去电子所需要的能量,根据电离能的大小确定最外层电子数,进而确定所处的族序数;
(2)非金属元素的氢化物沸点随着相对分子质量的增大而升高;存在氢键的物质的沸点较高;
(3)根据表中所给的物质可以看出是互为同系物的物质,根据分子组成和熔沸点的关系来得出结论,存在氢键的物质的沸点较高.
(2)非金属元素的氢化物沸点随着相对分子质量的增大而升高;存在氢键的物质的沸点较高;
(3)根据表中所给的物质可以看出是互为同系物的物质,根据分子组成和熔沸点的关系来得出结论,存在氢键的物质的沸点较高.
解答:解:(1)I.电离能是元素的原子失去电子所需要的能量,根据图象可以知道,元素的第三电离能之后数据相当大,说明易失去三个电子,最外层电子数为3,故为第ⅢA的元素,故答案为:IIIA;
II.图B中元素的氢化物的沸点变化规律的图象中,折线c可以得出该族元素的氢化物的沸点随着原子序数的递增,从上到下是逐渐升高的,符合第IVA元素的性质,没有特例出现,A点所示的氢化物是水,在水中,由于在水分子间存在氢键,其沸点高于氧族元素中的其它氢化物的沸点,即曲线b符合要求,故答案为:b;A点所示的氢化物是水,由于在水分子间存在氢键,所以其沸点高于氧族元素中的其它氢化物的沸点;
(2)根据表中所给的物质可以看出:前三种和后四种物质均是互为同系物,发现同系物相对分子质量越大、分子间作用力越强,沸点越高,并且是当有机能形成分子内氢键时,分子间作用力减弱,熔点变低;当分子间能形成氢键时,分子间作用力增强,熔点升高,故答案为:同系物相对分子质量越大、分子间作用力越强,故沸点越高;当有机能形成分子内氢键时,分子间作用力减弱,熔点变低(当分子间能形成氢键时,分子间作用力增强,熔点升高).
II.图B中元素的氢化物的沸点变化规律的图象中,折线c可以得出该族元素的氢化物的沸点随着原子序数的递增,从上到下是逐渐升高的,符合第IVA元素的性质,没有特例出现,A点所示的氢化物是水,在水中,由于在水分子间存在氢键,其沸点高于氧族元素中的其它氢化物的沸点,即曲线b符合要求,故答案为:b;A点所示的氢化物是水,由于在水分子间存在氢键,所以其沸点高于氧族元素中的其它氢化物的沸点;
(2)根据表中所给的物质可以看出:前三种和后四种物质均是互为同系物,发现同系物相对分子质量越大、分子间作用力越强,沸点越高,并且是当有机能形成分子内氢键时,分子间作用力减弱,熔点变低;当分子间能形成氢键时,分子间作用力增强,熔点升高,故答案为:同系物相对分子质量越大、分子间作用力越强,故沸点越高;当有机能形成分子内氢键时,分子间作用力减弱,熔点变低(当分子间能形成氢键时,分子间作用力增强,熔点升高).
点评:本题是一道有关元素周期表和元素周期律知识的综合题目,考查学生分析和解决问题的能力,难度中等.

练习册系列答案
相关题目
 图表法、图象法是常用的科学研究方法.
图表法、图象法是常用的科学研究方法.