网址:http://m.1010jiajiao.com/timu3_id_3944322[举报]
(1)常温下,X、Y的水溶液的pH均为5,则两种水溶液中由水电离出的H+浓度之比是__________。
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式_______________________________________。
(3)将铝片和镁片用导线相连,插入由A、D、E三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为_______________________________________。
(4)化学反应![]() 2CA3(g)。
2CA3(g)。
当反应达到平衡时不断改变条件(不改变A2、C2和CA3的量),下图表示反应速率与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是________________________。温度为T ℃时,将

(5)化合物A8B4D2有如下转化关系:

其中,g是常用调味品的主要成分。写出反应①的化学方程式__________________________。
设计实验方案完成d→e的转化____________________________________________________。
查看习题详情和答案>>(1)常温下将气体B通入水中发生反应,生成A和D,则D的化学式为_________________。
(2)E分子的空间构型是_______________________;写出E与氧气反应生成A的化学方程式_______________________________________________。
(3)写出工业合成E反应的化学方程式______________________________________________。
若使该平衡向生成E的方向移动,可采取的措施有(填字母序号)__________________。
A.升高温度 B.增大压强
C.使用催化剂 D.液化分离E
(4)D和E生成的化合物在某温度下加热分解,同时生成两种氧化物。且在此过程中,若有0.5 mol该化合物完全反应,转移电子数为2 mol。写出该反应的化学方程式__________________
_____________________________________________________________________。
查看习题详情和答案>>A、B、C、D、E是含有同一种元素的常见物质。C物质只由一种元素组成,在1个C分子中形成共价键的电子数与分子中所含电子数之比为3∶7。C、E均可与氧气在一定条件下反应生成A。请回答以下问题:
(1)常温下将气体B通入水中发生反应,生成A和D,则D的化学式为_________________。
(2)E分子的空间构型是____________;写出E与氧气反应生成A的化学方程式:_________。
(3)写出工业合成E反应的化学方程式:________________________;若使该平衡向生成E的方向移动,可采取措施有________________________(填字母序号)。
A.升高温度 B.增大压强
C.使用催化剂 D.液化分离E
(4)D和E生成的化合物在某温度下加热分解,同时生成两种氧化物。且在此过程中,若有0.5 mol该化合物完全反应,转移电子数为2 mol。写出该反应的化学方程式:______________。
查看习题详情和答案>>A、B、C、D、E五种元素均为短周期元素,原子序数逐渐增大,A元素原子的核外电![]() 子数、电子层数和最外层电子数均相等。B、C、D、E三种元素在周期表中相对位置如下左图,只有E元素的单质能与水反应生成两种酸。甲、乙、M、W、X、Y、Z七种物质均由A、C、D三种元素中的若干种组成(只有M分子同时含有三种元素),其中甲、乙为非金属单质,W由A和C组成,分子中含有18个电子,X分子含有10个电子,它们之间的相互转化关系如下右图:
子数、电子层数和最外层电子数均相等。B、C、D、E三种元素在周期表中相对位置如下左图,只有E元素的单质能与水反应生成两种酸。甲、乙、M、W、X、Y、Z七种物质均由A、C、D三种元素中的若干种组成(只有M分子同时含有三种元素),其中甲、乙为非金属单质,W由A和C组成,分子中含有18个电子,X分子含有10个电子,它们之间的相互转化关系如下右图:
| B | C | D | |
| E |
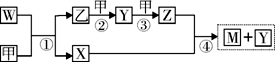
(1)E的单质与水反应的离子方程式为 ;
(2)乙的电子式为 ,元素A与B形成原子个数比为1∶1的相对分子质量最小化合物的结构式为 ;
(3)A、C、D三种元素组成一种强酸弱碱盐的化学式为 ,其水溶液中各种离子浓度由大到小顺序为 ;
(4)反应④的化学方程式为 ;
(5)W作火箭燃料时,氧化剂可以是Z,已知32 g W气体完全和Z气体反应生成乙和气态 X,放出576.85 kJ热量,写出该反应的热化学方程式 。
查看习题详情和答案>>A、B、C、D、E、F均为短周期元素,且原子序数依次增大,A是原子半径最小的元素,B的最髙价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4 : 1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离子相差一个电子层,且可形成离子个数比为
2 : 1的离子化合物丙。
(1) D的原子结构示意图为 (1分),丙的电子式为 ,E在周期表中的位置为 (2分)。
(2) 下列说法正确的有 (2分)。
①化合物乙为正四面体形分子,是由极性键构成的非极性分子
②C、D、E、F原子半径由大到小的顺序为C>D>E>F
③B、E形成的氢化物中,B的氢化物稳定性更强,是因为该分子中存在氢键
④化合物甲和化合物丙都含有离子键和共价键
(3) 已知通常状况下1gF在空气中完全燃烧放出a kj的热量,请写出表示F燃烧热的热化学方程式 。将燃烧产物通入BaCl2和HNO3的混合溶液,生成白色沉淀并放出无色气体,请用一个离子方程式表示该反应 (2 分)。
(4) 写出一个由以上元素构成的1Oe-微粒与18e-微粒反应的离子方程式:
及其他合理答案。
查看习题详情和答案>>