摘要:9.一定条件下.某容积为1L的密闭容器中发生如下反应:C(s)+H2O(g)CO(g)+H2(g) 维持温度不变.向该容器中充入2 mol C(s)和2 mol H2O(g).达到平衡后混合气体的平均相对分子质量为Mr.则Mr的范围为 . 中若充入的是2.5 mol CO(g)和4 mol H2(g).达到平衡后混合气体的平均相对分子质量为 ,若要求达到平衡后混合气体的平均相对分子质量始终大于该值.则充入的CO.H2混合气体的总质量m和总物质的量n必须满足的关系为 . (Ⅱ)维持温度不变.若在(1)中同时充入1 mol Br2(g).发生如下反应:H2(g)+Br2(g)2HBr (3)当上述体系达到平衡后.测得容器中c(H2O)平=0.4 mol·L-1.c(Br2)平=0.6 mol·L-1.则平衡时c(H2)平= mol·L-1. (4)当上述体系达到平衡时.欲求其混合气体的平衡组成.则至少还需要知道两种气体的平衡浓度.但这两种气体不可能同时是: 和 .或 和 .
网址:http://m.1010jiajiao.com/timu3_id_393897[举报]
一定条件下,某容积为1L的密闭容器中发生如下反应:
C(s)+H2O(g) CO(g)+H2 (g)
CO(g)+H2 (g)
(1)维持温度不变,向该容器中充入2 mol C(s)和2 mol H2O(g),达到平衡后混合气体的平均相对分子质量为Mr,则Mr的范围为 。
(2)达到平衡后,保持容器容积不变,向体系中再加入一定质量的C,逆反应速率 (填“增大”、 “减小”或“不变”),化学平衡 (填“正移”、 “逆移”或“不变”);若保持温度不变,压缩容积,逆反应速率 ,化学平衡 。
一定条件下,某容积为1L的密闭容器中发生如下反应:
C(s)+H2O(g) CO(g)+H2 (g)
CO(g)+H2 (g)
(1)维持温度不变,向该容器中充入2 mol C(s)和2 mol H2O(g),达到平衡后混合气体的平均相对分子质量为Mr,则Mr的范围为 。
(2)达到平衡后,保持容器容积不变,向体系中再加入一定质量的C,逆反应速率 (填“增大”、 “减小”或“不变”),化学平衡 (填“正移”、 “逆移”或“不变”);若保持温度不变,压缩容积,逆反应速率 ,化学平衡 。
查看习题详情和答案>>
一定条件下,某容积为1L的密闭容器中发生如下反应:
C(s)+H2O(g) CO(g)+H2 (g)
CO(g)+H2 (g)
(1)维持温度不变,向该容器中充入2 mol C(s)和2 mol H2O(g),达到平衡后混合气体的平均相对分子质量为Mr,则Mr的范围为 。
(2)达到平衡后,保持容器容积不变,向体系中再加入一定质量的C,逆反应速率 (填“增大”、 “减小”或“不变”),化学平衡 (填“正移”、 “逆移”或“不变”);若保持温度不变,压缩容积,逆反应速率 ,化学平衡 。
C(s)+H2O(g)
 CO(g)+H2 (g)
CO(g)+H2 (g)(1)维持温度不变,向该容器中充入2 mol C(s)和2 mol H2O(g),达到平衡后混合气体的平均相对分子质量为Mr,则Mr的范围为 。
(2)达到平衡后,保持容器容积不变,向体系中再加入一定质量的C,逆反应速率 (填“增大”、 “减小”或“不变”),化学平衡 (填“正移”、 “逆移”或“不变”);若保持温度不变,压缩容积,逆反应速率 ,化学平衡 。
在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);测得CO2和CH3OH(g)的浓度随时间变化如图1所示.该反应过程中的能量变化如图2所示.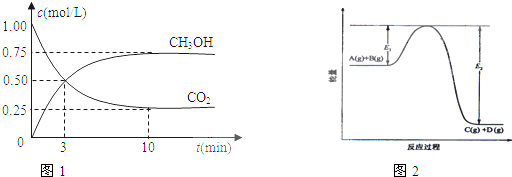
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=
(2)该反应的平衡常数表达式为
(3)如果在达平衡后某一时刻保持温度不变,只改变浓度,使c(CO2)=1.00mol/L,c(H2)=0.40mol/L,c(CH3OH)=c(H2O)=0.80mol/L,则平衡
a.向正反应方向移动 b.向逆反应方向移动 c.不移动 d.无法确定平衡移动方向
(4)下列措施中能使
增大的是
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
(5)在反应体系中加入催化剂,E1和E2的变化是:E1
查看习题详情和答案>>

(1)从反应开始到平衡,氢气的平均反应速率v(H2)=
0.225
0.225
mol/(L?min).(2)该反应的平衡常数表达式为
K=
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
K=
.该条件下的平衡常数K=| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
5.33
5.33
(可用分数表示),温度升高,K值减少
减少
(填“增大”“不变”或者“减少”)(3)如果在达平衡后某一时刻保持温度不变,只改变浓度,使c(CO2)=1.00mol/L,c(H2)=0.40mol/L,c(CH3OH)=c(H2O)=0.80mol/L,则平衡
b
b
(填写序号).a.向正反应方向移动 b.向逆反应方向移动 c.不移动 d.无法确定平衡移动方向
(4)下列措施中能使
| n(CH3OH) |
| n(CO2) |
CD
CD
.A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
(5)在反应体系中加入催化剂,E1和E2的变化是:E1
减小
减小
,E2减小
减小
(填“增大”“减小、”“不变”).对反应热是否有影响?无
无
,原因是催化剂不能改变反应物的总能量与生成物总能量的差值,即反应热不变
催化剂不能改变反应物的总能量与生成物总能量的差值,即反应热不变
.
在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ
测得CO2和CH3OH(g)的浓度随时间变化如图所示:
(1)从反应开始到第10min,氢气的平均反应速率v(H2)=______,在这段时间内,反应放出的热量=______.
(2)在该条件下,反应的平衡常数K的值=______(保留2位小数),如果在某一时刻保持温度不变,只改变浓度,使c(CO2)=1.00mol/L,c(H2)=0.40mol/L,c(CH3OH)=c(H2O)=0.80mol/L,则平衡______(填写序号).
a.向正反应方向移动 b.向逆反应方向移动
c.不移动 d.无法确定平衡移动方向
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是______(填写序号).
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离 d.再充入1mol CH3OH(g)
(4)在催化剂的作用下,CO2与H2能够合成许多物质,如甲醇.烃类.二甲醚等,但反应体系中混入杂质,则反应很难进行,可能的原因是______.
 查看习题详情和答案>>
查看习题详情和答案>>
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ
测得CO2和CH3OH(g)的浓度随时间变化如图所示:
(1)从反应开始到第10min,氢气的平均反应速率v(H2)=______,在这段时间内,反应放出的热量=______.
(2)在该条件下,反应的平衡常数K的值=______(保留2位小数),如果在某一时刻保持温度不变,只改变浓度,使c(CO2)=1.00mol/L,c(H2)=0.40mol/L,c(CH3OH)=c(H2O)=0.80mol/L,则平衡______(填写序号).
a.向正反应方向移动 b.向逆反应方向移动
c.不移动 d.无法确定平衡移动方向
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是______(填写序号).
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离 d.再充入1mol CH3OH(g)
(4)在催化剂的作用下,CO2与H2能够合成许多物质,如甲醇.烃类.二甲醚等,但反应体系中混入杂质,则反应很难进行,可能的原因是______.
 查看习题详情和答案>>
查看习题详情和答案>>