网址:http://m.1010jiajiao.com/timu3_id_393616[举报]
(12分)一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g),△H<0。反应过程中SO2、O2、SO3物质的量变化如图所示:
2SO3(g),△H<0。反应过程中SO2、O2、SO3物质的量变化如图所示:
回答下列问题:
(1) 若降低温度,该反应的化学平衡常数 。(填“增大”“减小”或“不变”)
(2)该反应处于平衡状态的时间段为 。
(3)反应进行至20 min时,曲线发生变化的原因是 (用文字表达)。10 min到15 min的曲线变化的原因可能是 (填写编号)。
a. 加了催化剂 b. 缩小容器体积
c. 降低温度 d. 增加SO3的物质的量
(4)维持容器体积不变,向该反应的平衡体系中充入氮气 , 则平衡 ( 填“向左”或“向右”或“不”)移动;维持容器体积不变,向该反应的平衡体系中移走部分混合气体 , 则平衡 ( 填“向左”或“向右”或“不”) 移动。
(12分 每空两分)某同学用0.10 mol/L的HCl溶液测定未知浓度的NaOH溶液,其实验操作如下:
A.用酸式滴定管量取20.00mLHCl溶液注入锥形瓶,同时滴加2-3滴酚酞试液;
B.用0.10 mol/L的HCl溶液润洗酸式滴定管;
C.把滴定管用蒸馏水洗净;
D.取下碱式滴定管,用待测NaOH溶液润洗后,将待测NaOH溶液注入碱式滴定管至距离刻度“0”以上2—3cm处,再把碱式滴定管固定好,调节液面;
E.检查滴定管是否漏水;
F.另取锥形瓶,再重复以上操作1—2 次;
G.把锥形瓶放在碱式滴定管下边,瓶下垫一张白纸,边滴边摇动锥形瓶,直到加入l滴碱液后溶液颜色突变并在半分钟内不再变色为止,记下滴定管液面所在的刻度。请回答下列问题:
(1)(2分)滴定操作的正确顺序是:(填字母)
→C→ →B→
→ → __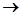 。
。
(1) G步操作中在锥形瓶下垫一张白纸是的作用是 。
(3)D步操作中液面应调节到 ,尖嘴部分应 。
(4)滴定终点读数时,如果仰视液面,读出的数值 ,若滴定前平视读数则由此计算得到的NaOH溶液浓度 。(填“偏大”、“偏小”、“无影响”)
查看习题详情和答案>>
(12分)氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点—54.1℃,沸点69.1℃,遇水生成硫酸和氯化氢。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:SO2(g)+Cl2(g) SO2Cl2(l) △H=—97.3kJ/mol
SO2Cl2(l) △H=—97.3kJ/mol
⑴为了提高上述反应中Cl2的平衡转化率,下列措施合理的是 (用编号填空)。
| A.缩小容器体积 | B.使用催化剂 | C.增加SO2浓度 | D.升高温度 |
(3)已知某温度下,已知Ksp(AgCl)=2.0×10-10,Ksp(Ag2SO4)=1.6×10-5,在SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液,当Ag+浓度为0.1mol/L时,浑浊液中Cl-浓度与SO42-浓度之比为 。
⑷将(2)所得的平衡混合气溶于足量的BaCl2溶液中,计算最终生成沉淀的质量是多少(写出计算过程)。 查看习题详情和答案>>
(12分)在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2(g)  2SO3(g) ΔH<0
2SO3(g) ΔH<0
(1) 写出该反应的化学平衡常数表达式K=______ ____。降低温度,该反应K值___ ___,二氧化硫转化率______,化学反应速率___ ___。(以上均填“增大”“减小”或“不变”)
(2) 600 ℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间是____ ____。
(3)据上图判断,反应进行至20 min时,曲线发生变化的原因是________________ ___________________ (用文字表达);10 min到15 min的曲线变化的原因可能是________(填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
(4)已知在600℃时,2SO2(g)+O2(g)  2SO3(g)的平衡常数K=19,若600℃时测得容器内c(SO2)=0.3mol/L,c(O2)=0.1mol/L,c(SO3)=0.4mol/L,在这种情况下,该反应是否处于平衡状态? (填“是”或“否”)。此时,化学反应速率是v(正) v(逆)(填“>”、“<”或“=”),原因是 。
2SO3(g)的平衡常数K=19,若600℃时测得容器内c(SO2)=0.3mol/L,c(O2)=0.1mol/L,c(SO3)=0.4mol/L,在这种情况下,该反应是否处于平衡状态? (填“是”或“否”)。此时,化学反应速率是v(正) v(逆)(填“>”、“<”或“=”),原因是 。
(本题共12分)
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下:
根据题意回答:
1.实验中需用0.8mol/L的硫酸800 mL,若用98%的浓硫酸(ρ=" 1.84" g/mL)来配制,量取浓硫酸时,需使用的量筒的规格为
| A.10 mL | B.20 mL | C.50 mL | D.100 mL |
3.滤渣的主要成份除含有Fe(OH)3、Al(OH)3外,还有 。
4.在“除钙”前,需检验滤液中Fe3+是否被除尽,简述检验方法 。
5.已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
6.实验中提供的硼镁泥共100 g,得到的MgSO4·7H2O为172.2 g,则MgSO4·7H2O的产率为 。 查看习题详情和答案>>