网址:http://m.1010jiajiao.com/timu3_id_392310[举报]
A.8.9 t B.9.8 t C.6.0 t D.14.7 t
查看习题详情和答案>>
| 化学式 | 沉淀完全时的pH | 钴镍性质 | ||
| Co(OH)2 | 9.4 | Co+2HCl=CoCl2+H2↑ Co2++2NH3?H2O=Co(OH)2↓+2NH
Ni+2HCl=NiCl2+H2↑ Co2++2H2O?Co(OH)2+2H+ Ni2++6NH3?H2O=[Ni(NH3)6]2++6H2O | ||
| Fe(OH)2 | 9.6 | |||
| Fe(OH)3 | 3.7 |
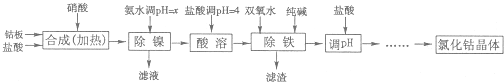
钴与盐酸反应极慢,需加入催化剂硝酸才可能进行实际生产.
(1)“除镍”步骤中,NH3?H2O用量对反应收率的影响,见下表:
| 加NH3?H2O调PH | 收率/% | Ni2+含量/% |
| 9 | 98.1 | 0.08 |
| 9.5 | 98 | 0.05 |
| 10 | 97.6 | 0.005 |
| 10.3 | 94 | 0.005 |
(2)“除镍”步骤必须控制在一定的时间内完成,否则沉淀将有部分Co(OH)3生成,试写出反应的化学方程式
(3)“除铁”步骤中加入双氧水发生反应的离子方程式是
(4)“除铁”步骤中加入的纯碱作用是
(5)在“调pH“步骤中,加盐酸的作用是
(6)已知25℃时,Ksp[Fe(OH)3]=4.0×10-38,则该温度下反应Fe3++3H2O?Fe(OH)3+3H+的平衡常数为
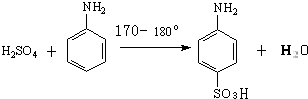
主要试剂及产品的物理常数:
| 名称 | 性状 | 熔点/°C | 沸点/°C | 在水中的溶解度(g/100mL) |
| 苯胺 | 无色油状液体 | -6.1 | 184.4 | 3.6/18℃ |
| 对氨基苯磺酸 | 无色结晶 | 熔点365°C;内盐280~290°C | 0.8/10℃;1.08/20℃;6.67/100℃ | |

①在一个250mL三颈烧瓶中加入10mL苯胺及几粒沸石,将三颈 烧瓶放入冷水中冷却,小心地加入18mL浓硫酸.如图所示,在三颈烧瓶的两个瓶口上分别装冷凝管、温度计(水银球浸入反应液中),另一个没有使用的瓶口用塞子塞紧.
②将三颈烧瓶置于
③将反应产物冷却至约50℃后,倒入盛有100mL冷水的烧杯中,用玻璃棒不断搅拌,促使对氨基苯磺酸晶体析出.用该烧杯中的少量冷水将烧瓶内残留的产物冲洗到烧杯中,抽滤,用少量冷水洗涤,得到的晶体是对氨基苯磺酸粗产品.
④为提高产品的纯度,将粗产品先
请回答下列问题:
(1)装置中冷凝管的作用是
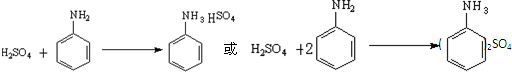

(2)步骤②中采用
(3)步骤③用少量冷水洗涤晶体的好处是
(4)步骤③和④均进行抽滤操作,在抽滤完毕停止抽滤时,应注意先
(5)步骤④中将粗产品先
(1)用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
若1mol CH4还原NO2至N2,整个过程中放出的热量为867kJ,则△H2=
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+ )实现氨的电化学合成,从而大大提高了氮气和氢气的转化率.电化学合成氨过程的总反应式为:N2+3H2
| ||
| 一定条件 |
(3)在一定条件下,将l mol N2与3mol H2混合于一个10L密闭容器中,反应达到平衡时,A点混合气体中氨占25%,
试回答:①N2的转化率为

②右图中在状态A时,平衡常数 KA
| 0.082 |
| 0.06×0.183 |
| 0.082 |
| 0.06×0.183 |
③在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
| 时间/min 浓度/mol.L |
c (N2) | c (H2) | c (NH3) |
| 0 | 0.6 | 1.8 | 0 |
| 3 | 0.52 | x | 0.16 |
| 6 | 0.36 | 1.08 | 0.48 |
| 9 | 0.36 | 1.08 | 0.48 |
a.使用催化剂 b.降低温度 c.增加H2的浓度.
(14分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产.生活中有着重要作用。请回答下列问题:
(1)用CH4 催化还原NOx 可以消除氮氧化物的污染。例如:
CH4(g) + 4NO2(g) = 4NO(g)+CO2(g) + 2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g) + 4NO(g) = 2 N2(g)+CO2(g) + 2H2O(g) ΔH2、
若1 mol CH4 还原NO2 至N2,整个过程中放出的热量为867 kJ,则ΔH2= ;
(2)工业合成氨气需要的反应条件非常高且产量低,而一些科学家采用高质子导电性的SCY陶瓷(能传递H+ )实现氨的电化学合成,从而大大提高了氮气和氢气的转化率。电化学合成氨过程的总反应式为:N2+3H2 2NH3 ,则在电化学合成氨的过程中,阴极反应式为
;
2NH3 ,则在电化学合成氨的过程中,阴极反应式为
;
(3)在一定条件下,将l mol N2 与3 mol H2 混合于一个10 L密闭容器中,反应达到平衡时,A点混合气体中氨占25%,试回答:

①A点时N2的浓度为 mol/L;
②右图中在状态A时,平衡常数 KA = (填写代入数值的表达式,不要求化简);当温度由T1变化到T2时,KA KB(填“>”、“<”或“=”)。
③在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
|
时间/min 浓度/mol•L—1 |
c (N2) |
c (H2) |
c (NH3) |
|
0 |
0.6 |
1.8 |
0 |
|
3 |
0.52 |
x |
0.16 |
|
6 |
0.36 |
1.08 |
0.48 |
|
9 |
0.36 |
1.08 |
0.48 |
反应从0 min到3 min之间,H2的反应速率为 ;反应在3 min时,条件发生了改变,改变的条件可能是 (填序号)。
a.使用催化剂 b.降低温度 c.增加H2的浓度 d.充入Ne增大压强
查看习题详情和答案>>