网址:http://m.1010jiajiao.com/timu3_id_392215[举报]
(1)下列可产生二氧化硫污染大气的是
A.含硫矿石的冶炼 B.大量化石燃料的燃烧
C.大量烟花爆竹的燃放 D.硫酸厂排放的工业尾气
(2)某课外小组采集了一份雨水样品,每隔一段时间测定该雨水样品的pH变化数据如下
| 测试时间段 | 0 | 1 | 2 | 3 | 4 |
| 雨水的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
(3)某实验小组欲探究二氧化硫的化学性质,设计如下实验,请完成实验报告.
| 序号 | 二氧化硫的性质 | 主要操作和现象 | 化学方程式 |
| ① | 将二氧化硫通入装有品红溶液的试管中,品红由红色变为无色 | ||
| ② | 氧化性 | ||
| ③ | 将二氧化硫通入装有新制氯水的试管中,氯水由浅黄绿色变为无色 |
 二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一.
二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一.(1)汽车尾气中主要含有CO、NO2、SO2、CO2气体,其中
CO(g)+NO2(g)═NO(g)+CO2(g)△H=-akJ?mol-1(a>0)
2CO(g)+2NO(g)═N2(g)+2CO2(g)△H=-bkJ?mol-1(b>0)
据此回答:若用标准状况下3.36升CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为
| 3(2a+b) |
| 80 |
| 3(2a+b) |
| 80 |
(2)在火力发电厂产生的废气中含有SO2、N2、CO等气体,为除去SO2,常用Ca(OH)2悬浊液洗涤废气,为了废物利用,再通入空气使反应产物转化为石膏(CaSO4?2H2O).写出有关的化学反应方程式
(3)硫酸工业生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g)
| 催化剂 |
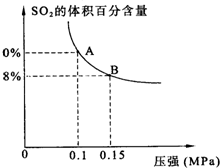
某温度下达到平衡时,SO2的体积百分含量与体系的总压强的关系如图所示:
据此图回答下列问题:
①平衡状态由A变到B时,反应体系
②将5molSO2和7molO2通入10L密闭容器中,平衡时体系的总压强为0.1MPa.该反应在该温度下的平衡常数等于
(1)汽车尾气中主要含有CO、NO2、SO2、CO2气体,其中________________能导致酸雨的形成;目前采用的是在汽车排气装置中安装一个净化器,可以有效的将尾气中的有害气体转化。
如:CO(g)+NO2(g)![]() NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
NO(g)+CO2(g) ΔH=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
N2(g)+2CO2(g) ΔH=-b kJ·mol-1(b>0)
据此回答:若用标准状况下
(2)在火力发电厂产生的废气中含有SO2、N2、CO等气体,为除去SO2,常用Ca(OH)2悬浊液洗涤废气,为了废物利用,再通入空气使反应产物转化为石膏(CaSO4·2H2O)。写出有关的化学反应方程式______________。
(3)硫酸工业生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196 kJ·mol-1
2SO3(g) ΔH=-196 kJ·mol-1

某温度下达到平衡时,SO2的体积百分含量与体系的总压强的关系如上图所示:
据此图回答下列问题:
①平衡状态由A变到B时,反应体系____________(填“吸收”或“释放”)能量。
②将5 mol SO2和7 mol O2通入
(1)汽车尾气中主要含有CO、NO2、SO2、CO2气体,其中______能导致酸雨的形成;目前采用的是在汽车排气装置中安装一个净化器,可以有效的将尾气中的有害气体转化.如:
CO(g)+NO2(g)═NO(g)+CO2(g)△H=-akJ?mol-1(a>0)
2CO(g)+2NO(g)═N2(g)+2CO2(g)△H=-bkJ?mol-1(b>0)
据此回答:若用标准状况下3.36升CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为______mol,放出的热量为______kJ(用含有a和b的代数式表示).
(2)在火力发电厂产生的废气中含有SO2、N2、CO等气体,为除去SO2,常用Ca(OH)2悬浊液洗涤废气,为了废物利用,再通入空气使反应产物转化为石膏.写出有关的化学反应方程式______.
(3)硫酸工业生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g)
 2SO3(g)△H=-196.kJ?mol-1
2SO3(g)△H=-196.kJ?mol-1某温度下达到平衡时,SO2的体积百分含量与体系的总压强的关系如图所示:
据此图回答下列问题:
①平衡状态由A变到B时,反应体系______(填“吸收”或“释放”)能量.
②将5molSO2和7molO2通入10L密闭容器中,平衡时体系的总压强为0.1MPa.该反应在该温度下的平衡常数等于______.
 查看习题详情和答案>>
查看习题详情和答案>>
二氧化硫和氮氧化物是常用的化工原料,也会给大气带来严重污染,综合治理其污染是环境化学当前的重要研究内容之一.汽车尾气中主要含有
CO、NO2、SO2、CO2气体,其中________能导致酸雨的形成.目前采用的是在汽车排气装置中安装一个净化器,可以有效的将尾气中的有害气体转化.如:CO(g)+NO2(g)![]() NO(g)+CO2(g) ΔH=-a kJ/mol(a>0)
NO(g)+CO2(g) ΔH=-a kJ/mol(a>0)
2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH=-b kJ/mol(b>0)
N2(g)+2CO2(g) ΔH=-b kJ/mol(b>0)
据此回答:若用标准状况下
3.36 L CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为________mol,放出的热量为________kJ(用含有a和b的代数式表示).