网址:http://m.1010jiajiao.com/timu3_id_39184[举报]
 化学反应过程发生物质变化同时常常伴能量变化,它以热能形式表现出来,叫反应热,它有很多种,燃烧热,中和热等.
化学反应过程发生物质变化同时常常伴能量变化,它以热能形式表现出来,叫反应热,它有很多种,燃烧热,中和热等.(1)许多化学反应的反应热可以直接测量,测量仪器叫做
(2)下列△H表示物质燃烧热的是
A.2H2(g)+O2(g)═2H2O(l);△H1
B.C(s)+
| 1 |
| 2 |
C.CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H3
D.C(s)+O2(g)═CO2(g);△H4
E.C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l);△H5
F.NaOH(ag)+HCl(ag)═NaCl(ag)+H2O(l);△H6
G.2NaOH(ag)+H2SO4(ag)═Na2SO4(ag)+2H2O(l);△H7
(3)已知15g乙烷完全燃烧生成CO2和液态水,放热a kJ,下列热化学方程式正确是
A.C2H6(g)+
| 7 |
| 2 |
B.C2H6(g)+
| 7 |
| 2 |
C.2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l);△H3=-4a kJ/mol
D.2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g);△H4=-2a kJ/mol
(4)充分燃烧一定丁烷放出热量161.9kJ,生成的CO2恰好与5mol/L 100mL KOH溶液完全反应生成正盐,则燃烧1mol丁烷放出能量为
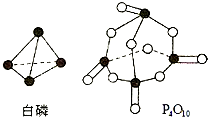
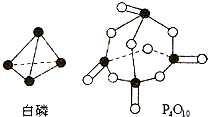
(5)进一步研究表明,化学反应能量变化与键能有关.键能简单理解断开1mol化学键吸收能量.下表是键能数据:
| 化学键 | P-P | P-O | O=O | P=O |
| 键能(kJ/mol) | 197 | 360 | 499 | X |
化学反应过程中发生物质变化的同时,常常伴有能量的变化.这种能量的变化常以热能的形式表现出来,叫做反应热.由于反应的情况不同,反应热可以分为许多种,如燃烧热和中和热,等等.
(1)下列ΔH表示物质燃烧热的是________;表示物质中和热的是________.(填ΔH1、ΔH2 和ΔH3等)
A.2H2(g)+O2(g)=2H2O(l) ΔH1;
B.C(s)+1/2O2(g)=CO(g) ΔH2
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH3;
D.C(s)+O2(g)=CO2(g) ΔH4;
E.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l) ΔH5
F.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH6
G.2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l); ΔH7
(2)2.00gC2H2气体完全燃烧生成液态水和CO2,放出99.6 kJ的热量.写出该反应的热化学方程式: 。
(3)充分燃烧一定量的丁烷放出的热量大小为Q,生成的CO2恰好与5 mol/L100mL KOH溶液完全反应.求燃烧1 mol丁烷放出的热量(设其数值为X) 。
(4)碳和碳的化合物在生产、生活中的应用非常广泛,“低碳生活”已成潮流,清洁能源的开发、煤的综合利用等是实现“低碳生活”的重要途径。甲烷是一种重要的清洁燃料,燃烧放出大量的热,可直接作为能源用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(l) △H1= —1214 kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2= —566 kJ/mol
则表示甲烷燃烧热的热化学方程式 ;
请从化学反应的本质解释甲烷燃烧放出热量的原因: 。
查看习题详情和答案>>(1)许多化学反应的反应热可以直接测量,测量仪器叫做______.
(2)下列△H表示物质燃烧热的是______(填序号);表示中和热的是______(填“△H1、△H2、或△H3”等).
A.2H2(g)+O2(g)═2H2O(l);△H1
B.C(s)+
| 1 |
| 2 |
C.CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H3
D.C(s)+O2(g)═CO2(g);△H4
E.C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l);△H5
F.NaOH(ag)+HCl(ag)═NaCl(ag)+H2O(l);△H6
G.2NaOH(ag)+H2SO4(ag)═Na2SO4(ag)+2H2O(l);△H7
(3)已知15g乙烷完全燃烧生成CO2和液态水,放热akJ,下列热化学方程式正确是______.
A.C2H6(g)+
| 7 |
| 2 |
B.C2H6(g)+
| 7 |
| 2 |
C.2C2H6(g)+7O2(g)═4CO2(g)+6H2O(l);△H3=-4akJ/mol
D.2C2H6(g)+7O2(g)═4CO2(g)+6H2O(g);△H4=-2akJ/mol
(4)充分燃烧一定丁烷放出热量161.9kJ,生成的CO2恰好与5mol/L100mLKOH溶液完全反应生成正盐,则燃烧1mol丁烷放出能量为______.
(5)进一步研究表明,化学反应能量变化与键能有关.键能简单理解断开1mol化学键吸收能量.下表是键能数据:
| 化学键 | P-P | P-O | O=O | P=O |
| 键能(kJ/mol) | 197 | 360 | 499 | X |
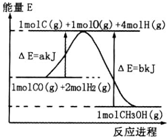 甲醇合成反应为:CO(g)+2H2(g)?CH3OH(g)工业上用天然气为原料,分为两阶段制备甲醇:
甲醇合成反应为:CO(g)+2H2(g)?CH3OH(g)工业上用天然气为原料,分为两阶段制备甲醇:(1)制备合成气:CH4+H2O(g)?CO+3H2.为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2:CO2+H2=CO+H2O.为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为
(2)合成甲醇:①反应过程中物质能量变化如右图所示.写出合成甲醇的热化学方程式
实验室在1L密闭容器中进行模拟合成实验.将1molCO和2molH2通入容器中,分别恒温在300℃和500℃反应,每隔一定时间测得容器中甲醇的浓度如下:(表中数据单位:mol?L-1)
| 10min | 20min | 30min | 40min | 50min | 60min | |
| 300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
| 500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
③500℃时平衡常数K的数值为
④300℃时,将容器的容积压缩到原来的
| 1 |
| 2 |
a.c(H2)减小 b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加d.重新平衡时c(H2)/c(CH3OH)减小.
(1)合成氨反应N2(g)+3H2(g)?2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
(2)甲烷在高温下与水蒸气反应的方程式为:CH4+H2O=CO+3H2.已知部分物质燃烧的热化学方程式如下:
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1
2CO(g)+O2(g)=2CO2(g)△H=-566kJ?mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ?mol-1
又知1molH2O(g)转变为1mol H2O(l)时放出44.0kJ热量.写出CH4和H2O在高温下反应的热化学方程式
(3)在25℃下,向浓度均为0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃烧电池.请写出该电池的正极反应式
(5)某温度(t℃)时,测得0.01mol?L-1的NaOH溶液的pH=11.在此温度下,将pH=a的H2SO4溶液VaL与pH=b的NaOH溶液VbL混合,若所得混合液为中性,且a+b=12,则Va:Vb=
(6)在25℃下,将a mol?L-1的氨水与0.01mol?L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-).则溶液显
| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |