摘要:13.08全国2 Q.R.X.Y.Z 为前 20 号元素中的五种. Q 的低价氧化物与X 单质分子的电子总数相等. R 与 Q 同族. Y 和 Z 的离子与 Ar 原子的电子结构相同且Y 的原子序数小于Z. ( l ) Q 的最高价氧化物.其固态属于 晶体.俗名叫 , ( 2 ) R 的氢化物分子的空间构型是 .属于 分子(填“极性 或“非极性 ) ,它与 X 形成的化合物可作为一种重要的陶瓷材料.其化学式是 , ( 3 ) X 的常见氢化物的空间构型是 ,它的另一氢化物X2H4是一种火箭燃料的成分.其电子式是 , ( 4 ) Q 分别与 Y.Z 形成的共价化合物的化学式是 和 , Q 与 Y 形成的分子的电子式是 .属于 分子.
网址:http://m.1010jiajiao.com/timu3_id_391529[举报]
向质量为30 g的Fe、Fe2O3混合物中加入250 mL 4 mol·L-1的稀硝酸恰好使混合物完全溶解,放出NO(标准状况)2.24 L,所得溶液中再滴加KSCN溶液,无血红色出现。若用与上述混合物中铁元素质量相等的铁屑和足量的稀硫酸充分反应,所得到的气体在标准状况下的体积为
- A.15.12 L
- B.10.08 L
- C.2.24 L
- D.3.36 L
(1997年全国,15)下列说法正确的是(N0表示阿伏加德罗常数的值) ( )
A.在常温常压下,11.2 L N2含有的分子数为0.5 N0
B.在常温常压下,1 mol Ne含有的原子数为N0
C.71 g Cl2所含原子数为2N0
D.在同温同压时,相同体积的任何气体单质所含的原子数相同
查看习题详情和答案>>Ⅰ.设反应①Fe(s)+CO2(g) ) FeO(s)+CO(g);△H=Q1的平衡常数为 K1,反应②Fe(s)+H2O(g)
FeO(s)+CO(g);△H=Q1的平衡常数为 K1,反应②Fe(s)+H2O(g)  FeO(s)+H2(g);△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g);△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
(1)从上表可推断,反应①是
(2)现有反应③H2(g)+CO2(g) CO(g)+H2O(g);△H=Q3平衡常数为K3.
CO(g)+H2O(g);△H=Q3平衡常数为K3.
根据反应①与②推导出K1、K2、K3的关系式K3=
;
可推断反应③是
A.缩小容器体积;B.降低温度;C.使用合适的催化剂;D.设法减少CO的量;E.升高温度
(3)根据反应①与②推导出Q1、Q2、Q3的关系式Q3=
Ⅱ.某强酸性反应体系中,反应物和生成物共六种物质:O2、MnO4-、H2O、Mn2+、H2O2、H+.已知该反应中H2O2 只发生了如下过程:H2O2→O2.
(1)该反应应选择的酸是:
A.盐酸 B.浓硫酸 C.稀硫酸 D.醋酸.
(2)该反应中发生还原反应的过程是:
(3)写出该反应配平的离子方程式并标出电子转移的方向和数目:

(4)如果上述反应中有6.72L(标准状况.)气体生成,转移的电子数为
(5)H2O2有时可作为矿业废液消毒剂,如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O═A+NH3↑,试指出生成物A的化学式为
(6)H2O2还有“绿色氧化剂”的美称,阐明H2O2被称为绿色氧化剂的理由是
查看习题详情和答案>>
 FeO(s)+CO(g);△H=Q1的平衡常数为 K1,反应②Fe(s)+H2O(g)
FeO(s)+CO(g);△H=Q1的平衡常数为 K1,反应②Fe(s)+H2O(g)  FeO(s)+H2(g);△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g);△H=Q2的平衡常数为K2,在不同温度下,K1、K2的值如下:| T/K | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1 173 | 2.15 | 1.67 |
吸
吸
(填“放”或“吸”)热反应.(2)现有反应③H2(g)+CO2(g)
 CO(g)+H2O(g);△H=Q3平衡常数为K3.
CO(g)+H2O(g);△H=Q3平衡常数为K3.根据反应①与②推导出K1、K2、K3的关系式K3=
| k1 |
| k2 |
| k1 |
| k2 |
可推断反应③是
吸
吸
(填“放”或“吸”)热反应.要使反应③在一定条件下建立的平衡右移,可采取的措施有DE
DE
.A.缩小容器体积;B.降低温度;C.使用合适的催化剂;D.设法减少CO的量;E.升高温度
(3)根据反应①与②推导出Q1、Q2、Q3的关系式Q3=
Q1-Q2
Q1-Q2
.Ⅱ.某强酸性反应体系中,反应物和生成物共六种物质:O2、MnO4-、H2O、Mn2+、H2O2、H+.已知该反应中H2O2 只发生了如下过程:H2O2→O2.
(1)该反应应选择的酸是:
C
C
(填序号).A.盐酸 B.浓硫酸 C.稀硫酸 D.醋酸.
(2)该反应中发生还原反应的过程是:
MnO4-
MnO4-
→Mn2+
Mn2+
.(3)写出该反应配平的离子方程式并标出电子转移的方向和数目:


(4)如果上述反应中有6.72L(标准状况.)气体生成,转移的电子数为
0.6
0.6
mol.(5)H2O2有时可作为矿业废液消毒剂,如消除采矿业胶液中的氰化物(如KCN),经以下反应实现:KCN+H2O2+H2O═A+NH3↑,试指出生成物A的化学式为
KHCO3
KHCO3
.(6)H2O2还有“绿色氧化剂”的美称,阐明H2O2被称为绿色氧化剂的理由是
H2O2是氧化剂,其产物是H2O;H2O没有毒性及污染性
H2O2是氧化剂,其产物是H2O;H2O没有毒性及污染性
.化学平衡状态I、II、Ⅲ的相关数据如下表:
根据以上信息判断,下列结论错误的是( )
| 编号 | 化学方程式 | 平衡常数 | 温度 | |
| 979K | 1173K | |||
| Ⅰ | Fe(s)+CO2?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| Ⅱ | CO(g)+H2O(g)?CO2(g)+H2(g) | K2 | 1.62 | b |
| Ⅲ | Fe(s)+H2O(g)? FeO(s)+H2(g) |
K3 | a | 1.68 |
| A、a>b |
| B、增大压强;平衡状态II不移动 |
| C、升高温度平衡状态Ⅲ向正反应方向移动 |
| D、反应Ⅱ,Ⅲ均为放热反应 |
I.设反应①Fe(s)+CO2(g)?FeO(s)+CO(g)的平衡常数为K1.反应 ②Fe(s)+H2O(g)?FeO(s)+H2(g)的平衡常数为K2,在不同温度下,K1、K2的值如下:
(1)现有反应③CO2(g)+H2(g)?CO(g)+H2O(g),这是一个 (填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有 (填序号).
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(2)若反应Fe(s)+CO2(g)?FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)?FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率 (填序号).
A.前者大 B.后者大 C.一样大 D.无法判断
II.(1)钢铁的表面发蓝、发黑处理是常用的防腐方法.请配平主要反应的方程式:
Na2FeO2+ NaNO2+ H2O═ NaFeO2+ NH3↑+ NaOH
(2)钢铁经冷、浓HNO3处理后“钝化”能达到防腐目的,不同浓度的HNO3与铁反应的还原产物很复杂,其分布曲线如下图.
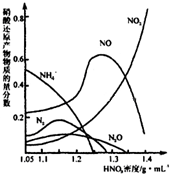
①图示可知,分析HNO3与铁反应的规律是 .
②工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是 .
(3)金属(M)的腐蚀是因为发生反应:M-ne-→Mn+,除了上述表面处理的方法外,下列方法也能起到防腐作用的是 (填字母编号)
A.在铁中掺入铬等金属制成不锈钢 B.在铁制品表面镀锌
C.提高铁中含碳量,制成生铁 D.将水库铁闸门与直流电源的负极相连.
查看习题详情和答案>>
| T(K) | K1 | K2 |
| 973 | 1.47 | 2.36 |
| 1173 | 2.15 | 1.67 |
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(2)若反应Fe(s)+CO2(g)?FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)?FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率
A.前者大 B.后者大 C.一样大 D.无法判断
II.(1)钢铁的表面发蓝、发黑处理是常用的防腐方法.请配平主要反应的方程式:
(2)钢铁经冷、浓HNO3处理后“钝化”能达到防腐目的,不同浓度的HNO3与铁反应的还原产物很复杂,其分布曲线如下图.

①图示可知,分析HNO3与铁反应的规律是
②工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是
(3)金属(M)的腐蚀是因为发生反应:M-ne-→Mn+,除了上述表面处理的方法外,下列方法也能起到防腐作用的是
A.在铁中掺入铬等金属制成不锈钢 B.在铁制品表面镀锌
C.提高铁中含碳量,制成生铁 D.将水库铁闸门与直流电源的负极相连.