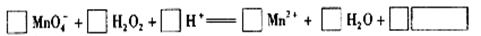题目内容
(12分)现用质量分数为98%、密度为1.84 g·cm-3的浓硫酸来配制500 mL、0.2 mol·L-1的稀硫酸。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④托盘天平 ⑤量筒 ⑥药匙
请完成下列问题:
(1)上述仪器中,在配制稀硫酸时用不到的有________(填代号),
除上述仪器外,还缺少的必要仪器是
(2)经计算,需浓硫酸的体积为________,现有①10 mL ②25 mL ③50 mL ④100 mL四种规格的量筒,你选用的量筒是________(填代号)。
(3)在配制过程中,其他操作都准确,下列操作中错误的是_____ ___________,能引起误差偏高的有_____ ___(填代号)。
①洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中 ③将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸 ④定容时,加蒸馏水超过标线,又用胶头滴管吸出 ⑤转移前,容量瓶中含有少量蒸馏水 ⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线 ⑦定容时,俯视标线
(12分) (1)②④⑥ 胶头滴管、500 mL容量瓶
(2)5.4 mL ① (3)①②③④⑥⑦ ①②⑦
解析试题分析:(1)硫酸是液体,不需要称量,因此不需要的仪器有托盘天平和钥匙。另外在一定物质的量浓度溶液的配制时,不需要烧瓶,答案选②④⑥。配制500ml溶液,因此还需要500ml容量瓶以及定容时的胶头滴管。
(2)由于稀释过程中溶质不变,所以需要浓硫酸的体积是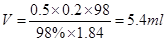 ,所以应该需要10ml量筒,答案选①。
,所以应该需要10ml量筒,答案选①。
(3)量取后量筒是不能把量筒中的洗涤液导入容量瓶中的,否则浓度偏高,①不正确;硫酸溶于水放出大量的热,所以冷却,否则浓度偏高,②不正确;稀释浓硫酸应该将浓硫酸沿着器壁注入水中,并不断搅拌,④男子气;⑥不正确,不应该再加入蒸馏水,否则浓度偏低;定容时俯视刻度线,是不正确的,应该是平视,否则浓度偏高。
考点:考查物质的量浓度溶液的配制及其误差分析等
点评:配制一定物质的量浓度溶液的实验是中学化学中一个重要的定量实验,实验过程中引起溶液浓度存在误差的因素有很多。从大的方面讲,一是由实验过程中的不规范操作引起的;二是由仪器或药品等系统原因引起的。

 走进文言文系列答案
走进文言文系列答案(12分)①制备纳米TiO2的方法之一是TiCl4水解生成TiO2·xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。
②用NaOH测定滤液的浓度:准确称量1.000gNaOH固体质量,配制成250mL溶液,准确量取25.00mL溶液装在碱式滴定管,滴加2滴酚酞作指示剂。把滤液装在酸式滴定管中,调节液面排除气泡后,滤液的凹液面刚好在“0”刻度,滴定NaOH溶液,达到终点记录读数。实验重复3次。记录见下表。
|
滴定次数 |
NaOH溶液体积/mL |
滴定消耗滤液体积/mL[来源: |
|
1 |
25.00 |
20.02 |
|
2 |
25.00 |
17.10 |
|
3 |
25.00 |
19.98 |
请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为_______________________________。
(2) 配制成250mL溶液使用的量具是 ,指示剂还可用____________;
(3) 滴定终点的现象是_______________________。
(4) 滤液中溶质的物质的量浓度为_____________。
(5) 若在滴定终点读取滴定管刻度时,俯视标准液液面,使对测定结果________。 (填“偏高”、“偏低”或“无影响”)
 2Al 2O3+9SO2,其中氧化剂为 。
2Al 2O3+9SO2,其中氧化剂为 。 2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向_______(填“正”或“逆”)方向进行。
2CO(g)的平衡常数K=1.64,相同条件下测得高炉内c(CO)=0.20 mol·L-1、c(CO2)=0.05 mol·L-1,此时反应向_______(填“正”或“逆”)方向进行。