摘要:16.8gNaHCO3和7.8gNa2O2在密闭容器中灼烧.充分反应后.将密闭容器保持温度为 500℃.最后容器内物质是( ) A.Na2CO3.Na2O.O2 B.Na2CO3.O2.H2O(g) C.Na2CO3.CO2.O2.H2O(g) D.NaHCO3.Na2CO3.O2
网址:http://m.1010jiajiao.com/timu3_id_390245[举报]
(1)氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用.回答下列问题:
①氮元素原子的L层电子数为 ;
②NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
③肼-空气燃料电池是一种碱性电池,该电池放电时,正极的反应式为 .
(2)一定质量的液态化合物XY2在标准状况下的一定质量的O2中恰好完全燃烧,反应方程式为:XY2(l)+3O2 (g)═XO2(g)+2YO2 (g)冷却后,在标准状况下测得生成物的体积是672mL,密度是2.56g/L,则:
①反应前O2的体积是 .
②化合物XY2的摩尔质量是 .
③XY2分子中X、Y两元素质量比是3:16,X、Y两元素分别为 (写元素符号)
查看习题详情和答案>>
①氮元素原子的L层电子数为
②NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为
③肼-空气燃料电池是一种碱性电池,该电池放电时,正极的反应式为
(2)一定质量的液态化合物XY2在标准状况下的一定质量的O2中恰好完全燃烧,反应方程式为:XY2(l)+3O2 (g)═XO2(g)+2YO2 (g)冷却后,在标准状况下测得生成物的体积是672mL,密度是2.56g/L,则:
①反应前O2的体积是
②化合物XY2的摩尔质量是
③XY2分子中X、Y两元素质量比是3:16,X、Y两元素分别为
已知A、E、I、L是常见的非金属单质,其中A为淡黄色固体;Z是常见的金属单质,B的相对分子质量比A大32,C的相对分子质量比B大16,Y是一种常见的液体,J是磁性氧化铁,D、H、K均是重要的化工产品;X分子的球棍模型如图所示,组成X的两种元素的相对原子质量相差18.下列框图中部分反应条件已略去.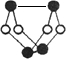
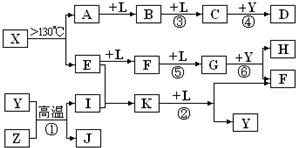
试回答下列问题:
(1)下列有关X的说法正确的是
A.该物质的分子式为S4N4
B.该物质的分子中既有极性键又有非极性键
C.该物质具有很高的熔、沸点
D.该物质与化合物S2N2互为同素异形体
(2)E的电子式为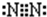
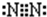 ,D的分子式
,D的分子式
(3)写出反应②的化学方程式:
(4)J与过量H的稀溶液反应的离子方程式为
查看习题详情和答案>>


试回答下列问题:
(1)下列有关X的说法正确的是
AB
AB
.A.该物质的分子式为S4N4
B.该物质的分子中既有极性键又有非极性键
C.该物质具有很高的熔、沸点
D.该物质与化合物S2N2互为同素异形体
(2)E的电子式为
H2SO4
H2SO4
,在反应①、②、③、④、⑤、⑥中属于非氧化还原反应的是④
④
.(填序号)(3)写出反应②的化学方程式:
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
(4)J与过量H的稀溶液反应的离子方程式为
3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O
3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O
.将一支20ml盛满NO2 和O2 混合气体的试管倒立盛水的水槽中,当充分反应并且水在试管中不再上升时,试管中仍余下2ml 气体.则原混合气体中NO2 的体积可为( )
| A、12.8 ml | B、17.2 ml | C、13.6 ml | D、16.8 ml |