摘要:16.已知BaCO3为白色沉淀.其Ksp为2.58×10-9 mol2·L-2,BaCrO4为黄色沉淀.其Ksp为1.17×10-10mol2·L-2.试管中盛有BaCO3的饱和溶液.溶液底部尚有固体BaCO3.若加入足量浓Na2CO3溶液.则下列描述正确的是 ( ) A.固体全部溶解 B.固体仍为白色 C.固体变为黄色 D.固体的物质的量不变
网址:http://m.1010jiajiao.com/timu3_id_389972[举报]
已知A、B、C、D、E、F 六种物质的转化关系如下:
①A+B→C+H2O
②C+KOH→D↓(蓝色)+E
③B+D→C+H2O
④E+BaCl2→KCl+F↓(白色,不溶于稀硝酸)
⑤G+B→CO2↑+F↓+H2O,反应中B与CO2的物质的量之比为1:2
根据上述变化关系填空:
(1)请写出下列物质的化学式:B
(2)检验E中阴离子的实验方法是
(3)往G的溶液中滴加过量的KOH,反应的离子方程式为
查看习题详情和答案>>
①A+B→C+H2O
②C+KOH→D↓(蓝色)+E
③B+D→C+H2O
④E+BaCl2→KCl+F↓(白色,不溶于稀硝酸)
⑤G+B→CO2↑+F↓+H2O,反应中B与CO2的物质的量之比为1:2
根据上述变化关系填空:
(1)请写出下列物质的化学式:B
H2SO4
H2SO4
;CCuSO4
CuSO4
;GBa(HCO3)2
Ba(HCO3)2
.(2)检验E中阴离子的实验方法是
先加入足量的稀盐酸,再加入氯化钡溶液,若有白色沉淀生成,则含有SO42-
先加入足量的稀盐酸,再加入氯化钡溶液,若有白色沉淀生成,则含有SO42-
(3)往G的溶液中滴加过量的KOH,反应的离子方程式为
Ba2++2HCO3-+2OH-=BaCO3↓+CO32-+2H2O
Ba2++2HCO3-+2OH-=BaCO3↓+CO32-+2H2O
.某无色溶液中含有K+、Cl-、OH-、CO32-、SO42-,为检验确认其中所含的各种阴离子,限用的试剂有:稀盐酸、稀硝酸、硝酸银溶液、硝酸钡溶液、澄清石灰水和酚酞试液,其中检验OH-的实验方法从略,已知检验其他阴离子的过程如图所示:
请你根据实验操作及现象分析完成下列各题:
(1)图中现象a、b、c表明检验出的阴离子分别是:a
(2)白色沉淀A加过量试剂②发生反应的离子方程式是:
(3)无色溶液A加试剂③的主要目的是:
(4)白色沉淀A若加试剂③而不加试剂②对实验结果有无影响(选填“有影响”、“无影响”或“无法确定”)
(5)气体B通入试剂④中发生反应的离子方程式是:
查看习题详情和答案>>
请你根据实验操作及现象分析完成下列各题:
(1)图中现象a、b、c表明检验出的阴离子分别是:a
CO32-
CO32-
,bSO42-
SO42-
,cCl-
Cl-
.(2)白色沉淀A加过量试剂②发生反应的离子方程式是:
BaCO3+2H+=Ba2++CO2↑+H2O
BaCO3+2H+=Ba2++CO2↑+H2O
.(3)无色溶液A加试剂③的主要目的是:
中和OH-,防止对Cl-的检验产生干扰
中和OH-,防止对Cl-的检验产生干扰
.(4)白色沉淀A若加试剂③而不加试剂②对实验结果有无影响(选填“有影响”、“无影响”或“无法确定”)
无影响
无影响
.(5)气体B通入试剂④中发生反应的离子方程式是:
Ca2++2OH-+CO2=CaCO3↓+H2O
Ca2++2OH-+CO2=CaCO3↓+H2O
.
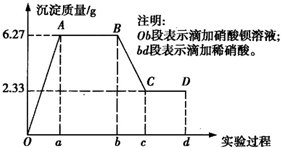 某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO
某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO2- 3 |
2- 4 |
(1)水样中一定含有的阴离子是
SO42-,CO32-
SO42-,CO32-
,其物质的量浓度之比为1:2
1:2
.(2)写出BC段所表示反应的离子方程式:
BaCO3+2H+=Ba2++CO2↑+H2O
BaCO3+2H+=Ba2++CO2↑+H2O
.(3)由B到C点变化过程中消耗硝酸的体积为
40ml
40ml
.(4)试根据实验结果推测K+是否存在?
是
是
(填“是”或“否”);若存在,K+的物质的量浓度c(K+)的范围是≥0.6mol/L
≥0.6mol/L
.(若K+不存在,则不必回答该问).(5)设计简单实验验证原水样中可能存在的离子:
取少量水样与试管中,向试管中加入过量升温硝酸钡溶液和稀硝酸,待沉淀完全和无气体生成后,向上层清液中滴加适量的硝酸银溶液,若生成白色沉淀,则原水样中 含有Cl-,若无白色沉淀生成,证明无Cl-存在
取少量水样与试管中,向试管中加入过量升温硝酸钡溶液和稀硝酸,待沉淀完全和无气体生成后,向上层清液中滴加适量的硝酸银溶液,若生成白色沉淀,则原水样中 含有Cl-,若无白色沉淀生成,证明无Cl-存在
.(写出实验步骤、现象和结论)现有A、B、C、D、E五种盐溶液,分别由K+、NH4+、Ag+、Ba2+、Al3+、Cl-、Br-、CO32-、SO42-、NO3- 中的阳离子和阴离子各一种组成(五种盐所含阴、阳离子各不相同)已知:
①A+B→白色沉淀 ②A+D→白色沉淀 ③A+C→白色沉淀
④D+B→白色沉淀+无色气体 ⑤A溶液中c(H+)=c(OH-)
⑥B溶液中c(H+)=1×10-12mol?L-1 ⑦C、D、E三种溶液的pH<7,
根据以上实验事实可以推出(用分子式表示)
A为
写出以上①②③④各步反应的离子方程式:
①
③
查看习题详情和答案>>
①A+B→白色沉淀 ②A+D→白色沉淀 ③A+C→白色沉淀
④D+B→白色沉淀+无色气体 ⑤A溶液中c(H+)=c(OH-)
⑥B溶液中c(H+)=1×10-12mol?L-1 ⑦C、D、E三种溶液的pH<7,
根据以上实验事实可以推出(用分子式表示)
A为
BaCl2
BaCl2
;B为K2CO3
K2CO3
;C为AgNO3
AgNO3
;D为Al2(SO4)
Al2(SO4)
;E为NH4Br
NH4Br
.写出以上①②③④各步反应的离子方程式:
①
Ba2++CO32-═BaCO3↓
Ba2++CO32-═BaCO3↓
,②Ba2++SO42-═BaSO4↓
Ba2++SO42-═BaSO4↓
,③
Ag++Cl-═AgCl↓
Ag++Cl-═AgCl↓
,④2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑
2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑
.钡(Ba)和锶(Sr)及其化合物在工业上有着广泛的应用,它们在地壳中常以硫酸盐的形式存在,BaSO4和SrSO4都是难溶性盐.工业上提取钡和锶时首先将BaSO4和SrSO4转化成难溶弱酸盐.
已知:SrSO4(s)?Sr2+(aq)+SO2-4(aq) KSP=2.5×10-7
SrSO3(s)?Sr2+(aq)+CO2-4(aq) KSP=2.5×10-9
(1)将SrSO4转化成SrCO3的离子方程式为 ,该反应的平衡常数表达式为 ;该反应能发生的原因是 .(用沉淀溶解再平衡的有关理论解释)
(2)对于上述反应,实验证明增大CO2-3的浓度或降低温度都有利于提高SrSO4的转化率.判断在下列两种情况下,平衡常数K的变化情况(填“增大”、“减小”或“不变”):
①升高温度,平衡常数K将 ;
②增大CO2-3的浓度,平衡常数K将 .
(3)已知,SrSO4和SrCO3在酸中的溶解性与BaSO4和BaCO3类似,设计实验证明上述过程中SrSO4是否完全转化成SrCO3.实验所用试剂为 ;实验现象及其相应结论 .
(4)BaCl2溶液和Ba(NO3)2溶液是实验中检验SO2-4的常用试剂.某化学研究性学习小组检验某溶液中存在SO2-4时,首先加入Ba(NO3)2溶液,产生白色沉淀,然后加入过量稀硝酸,白色沉淀不溶解,由此得出结论:溶液中一定含有SO2-4.你认为该推理是否严密?试说明理由.
查看习题详情和答案>>
已知:SrSO4(s)?Sr2+(aq)+SO2-4(aq) KSP=2.5×10-7
SrSO3(s)?Sr2+(aq)+CO2-4(aq) KSP=2.5×10-9
(1)将SrSO4转化成SrCO3的离子方程式为
(2)对于上述反应,实验证明增大CO2-3的浓度或降低温度都有利于提高SrSO4的转化率.判断在下列两种情况下,平衡常数K的变化情况(填“增大”、“减小”或“不变”):
①升高温度,平衡常数K将
②增大CO2-3的浓度,平衡常数K将
(3)已知,SrSO4和SrCO3在酸中的溶解性与BaSO4和BaCO3类似,设计实验证明上述过程中SrSO4是否完全转化成SrCO3.实验所用试剂为
(4)BaCl2溶液和Ba(NO3)2溶液是实验中检验SO2-4的常用试剂.某化学研究性学习小组检验某溶液中存在SO2-4时,首先加入Ba(NO3)2溶液,产生白色沉淀,然后加入过量稀硝酸,白色沉淀不溶解,由此得出结论:溶液中一定含有SO2-4.你认为该推理是否严密?试说明理由.