题目内容
某无色溶液中含有K+、Cl-、OH-、CO32-、SO42-,为检验确认其中所含的各种阴离子,限用的试剂有:稀盐酸、稀硝酸、硝酸银溶液、硝酸钡溶液、澄清石灰水和酚酞试液,其中检验OH-的实验方法从略,已知检验其他阴离子的过程如图所示:
请你根据实验操作及现象分析完成下列各题:
(1)图中现象a、b、c表明检验出的阴离子分别是:a
(2)白色沉淀A加过量试剂②发生反应的离子方程式是:
(3)无色溶液A加试剂③的主要目的是:
(4)白色沉淀A若加试剂③而不加试剂②对实验结果有无影响(选填“有影响”、“无影响”或“无法确定”)
(5)气体B通入试剂④中发生反应的离子方程式是: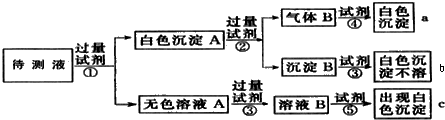
请你根据实验操作及现象分析完成下列各题:
(1)图中现象a、b、c表明检验出的阴离子分别是:a
CO32-
CO32-
,bSO42-
SO42-
,cCl-
Cl-
.(2)白色沉淀A加过量试剂②发生反应的离子方程式是:
BaCO3+2H+=Ba2++CO2↑+H2O
BaCO3+2H+=Ba2++CO2↑+H2O
.(3)无色溶液A加试剂③的主要目的是:
中和OH-,防止对Cl-的检验产生干扰
中和OH-,防止对Cl-的检验产生干扰
.(4)白色沉淀A若加试剂③而不加试剂②对实验结果有无影响(选填“有影响”、“无影响”或“无法确定”)
无影响
无影响
.(5)气体B通入试剂④中发生反应的离子方程式是:
Ca2++2OH-+CO2=CaCO3↓+H2O
Ca2++2OH-+CO2=CaCO3↓+H2O
.
分析:CO32-、SO42-与Ba(NO3)2溶液反应分别生成碳酸钡和硫酸钡白色沉淀,碳酸钡与盐酸反应生成二氧化碳气体,二氧化碳能使澄清石灰水变浑浊,故试剂①为Ba(NO3)2溶液,试剂②为盐酸或硝酸,试剂④为澄清石灰水;无色溶液A呈碱性,加入过量硝酸调整溶液呈酸性,再加入试剂⑤硝酸银溶液,生成氯化银白色沉淀,由以上分析可知溶液中含有Cl-、CO32-、SO42-.
解答:解:(1)因CO32-、SO42-与Ba(NO3)2溶液反应分别生成碳酸钡和硫酸钡白色沉淀,碳酸钡与盐酸反应生成二氧化碳气体,二氧化碳能使澄清石灰水变浑浊,硫酸钡不溶解,故试剂①为Ba(NO3)2溶液,试剂②为盐酸或硝酸,试剂④为澄清石灰水,所以现象a检验出的阴离子为CO32-,现象b检验出的阴离子为SO42-;无色溶液A呈碱性,加入过量试剂③硝酸调整溶液呈酸性,再加入试剂⑤硝酸银溶液,生成氯化银白色沉淀,故现象c检验出的阴离子为Cl-,故答案为:CO32-、SO42-、Cl-;
(2)白色沉淀A为碳酸钡和硫酸钡的混合物,加入过量的稀盐酸,碳酸钡溶解,生成二氧化碳,离子方程式为:BaCO3+2H+=Ba2++CO2↑+H2O,故答案为:BaCO3+2H+=Ba2++CO2↑+H2O;
(3)无色溶液A中含有OH-,OH-和硝酸银反应生成氧化银黑色沉淀,干扰对Cl-的检验,所以加入过量稀硝酸,中和OH-,防止对Cl-的检验产生干扰,故答案为:中和OH-(或酸化),防止对Cl-的检验产生干扰;
(4)白色沉淀A若加试剂③稀硝酸而不加试剂②稀盐酸对实验结果无影响,不干扰SO42-的检验,故答案为:无影响;
(5)气体B为二氧化碳,通入试剂④澄清石灰水中,石灰水变浑浊,离子方程式为:Ca2++2OH-+CO2=CaCO3↓+H2O,故答案为:Ca2++2OH-+CO2=CaCO3↓+H2O.
(2)白色沉淀A为碳酸钡和硫酸钡的混合物,加入过量的稀盐酸,碳酸钡溶解,生成二氧化碳,离子方程式为:BaCO3+2H+=Ba2++CO2↑+H2O,故答案为:BaCO3+2H+=Ba2++CO2↑+H2O;
(3)无色溶液A中含有OH-,OH-和硝酸银反应生成氧化银黑色沉淀,干扰对Cl-的检验,所以加入过量稀硝酸,中和OH-,防止对Cl-的检验产生干扰,故答案为:中和OH-(或酸化),防止对Cl-的检验产生干扰;
(4)白色沉淀A若加试剂③稀硝酸而不加试剂②稀盐酸对实验结果无影响,不干扰SO42-的检验,故答案为:无影响;
(5)气体B为二氧化碳,通入试剂④澄清石灰水中,石灰水变浑浊,离子方程式为:Ca2++2OH-+CO2=CaCO3↓+H2O,故答案为:Ca2++2OH-+CO2=CaCO3↓+H2O.
点评:物质的检验是高中化学的重点,也是高考的热点之一,了解物质或离子的化学性质,是本题解题的关键.

练习册系列答案
相关题目
某无色溶液中含有K+,Cl-,OH-,S
,S
,为了检验除OH-外的其他所有阴离子,拟用盐酸、硝酸、硝酸银溶液、氢氧化钡溶液、溴水和酚酞六种试剂,设计如下实验步骤,并记录相关现象:
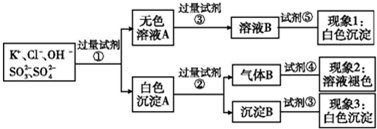
下列有关结论错误的是( )
| O | 2- 3 |
| O | 2- 4 |

下列有关结论错误的是( )
| A、试剂③是AgNO3溶液,试剂⑤是HNO3,现象1中白色沉淀是AgCl | ||
| B、现象3中白色沉淀是BaSO4 | ||
C、产生现象2的离子方程式是:Br2+2H2O+SO2=4H++2Br-+S
| ||
| D、试剂②是盐酸,试剂③是硝酸 |
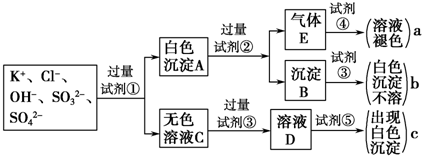
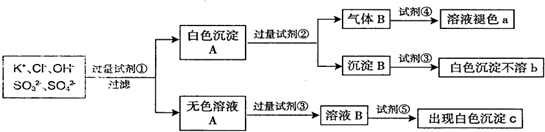
 、
、 ,为检验确认其中所含的各种阴离子,限用的试剂有:稀盐酸、稀硝酸、硝酸银溶液、硝酸钡溶液、澄清石灰水和酚酞试液,其中检验OH-的实验方法从略,已知检验其他阴离子的过程如下图所示:
,为检验确认其中所含的各种阴离子,限用的试剂有:稀盐酸、稀硝酸、硝酸银溶液、硝酸钡溶液、澄清石灰水和酚酞试液,其中检验OH-的实验方法从略,已知检验其他阴离子的过程如下图所示: