网址:http://m.1010jiajiao.com/timu3_id_389934[举报]
用盐酸制取等量的Cl2,被氧化的HCl的量最少的是( )
A.KClO3+6HCl KCl+3Cl2↑+H2O
B.Ca(ClO)2+4HCl CaCl2+2Cl2↑+2H2O
C.MnO2+4HCl MnCl2+Cl2↑+2H2O
D.2KMnO4+16HCl 2KCl+2MnCl2+5Cl2↑+8H2O
有下列三种制取氯气的方法:①实验室用二氧化锰跟浓盐酸反应制取氯气;②KMnO4是一种常用的氧化剂.在酸性条件下,可用高锰酸钾跟浓盐酸在室温下制氯气,其中![]() 被还原成Mn2+;③历史上曾用“地康法”制氯气,是用CuCl2作催化剂,在450℃利用空气中的氧气跟氯化氢反应制氯气.比较以上三个反应,下列说法不正确的是
被还原成Mn2+;③历史上曾用“地康法”制氯气,是用CuCl2作催化剂,在450℃利用空气中的氧气跟氯化氢反应制氯气.比较以上三个反应,下列说法不正确的是
[ ]
A.三个反应中,HCl均是还原剂,Cl2为氧化产物
B.三个反应中,可以判断氧化能力从强到弱顺序为KMnO4>MnO2>O2
C.用三种方法制取1mol氯气,转移电子数目相等
D.等物质的量的二氧化锰、高锰酸钾、氧气与足量HCl反应,生成Cl2的物质的量相等
查看习题详情和答案>>氯气在生产生活中应用广泛。实验室可用MnO2与浓盐酸反应制取,反应原理如下:MnO2+4HCl(浓)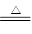 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)若制得标准状况下11.2 L Cl2,则被氧化的HCl为___________mol。
(2)多余的氯气可用NaOH溶液吸收,反应的离子方程式为__________。
(3)海底蕴藏着丰富的锰结核矿,其主要成分是MnO2。1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如下图所示:
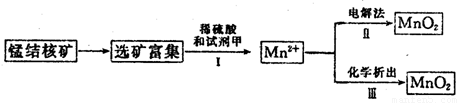
①步骤Ⅰ中, 试剂甲必须具有的性质是____________(填序号)。
A.氧化性B.还原性C.酸性
②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050 mol MnO2时,消耗0.10 mol·L-1的NaClO3溶液200 mL,该反应的离子方程式为___________________________。
(4)用100mL12.0 mol·L-1的浓盐酸与足量MnO2混合后,加热,反应产生的氯气物质的量远远少于0.30 mol,请你分析可能的原因为___________________________。
查看习题详情和答案>>
氯气在生产生活中应用广泛。实验室可用MnO2与浓盐酸反应制取,反应原理如下:MnO2+4HCl(浓)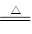 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)若制得标准状况下11.2 L Cl2,则被氧化的HCl为___________mol。
(2)多余的氯气可用NaOH溶液吸收,反应的离子方程式为__________。
(3)海底蕴藏着丰富的锰结核矿,其主要成分是MnO2。1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如下图所示:
①步骤Ⅰ中, 试剂甲必须具有的性质是____________(填序号)。
A.氧化性B.还原性C.酸性
②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050 mol MnO2时,消耗0.10 mol·L-1的NaClO3溶液200 mL,该反应的离子方程式为___________________________。
(4)用100mL12.0 mol·L-1的浓盐酸与足量MnO2混合后,加热,反应产生的氯气物质的量远远少于0.30 mol,请你分析可能的原因为___________________________。
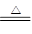 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O(1)若制得标准状况下11.2 L Cl2,则被氧化的HCl为___________mol。
(2)多余的氯气可用NaOH溶液吸收,反应的离子方程式为__________。
(3)海底蕴藏着丰富的锰结核矿,其主要成分是MnO2。1991年由Allen等人研究,用硫酸淋洗后使用不同的方法可制备纯净的MnO2,其制备过程如下图所示:

①步骤Ⅰ中, 试剂甲必须具有的性质是____________(填序号)。
A.氧化性B.还原性C.酸性
②步骤Ⅲ中,以NaClO3为氧化剂,当生成0.050 mol MnO2时,消耗0.10 mol·L-1的NaClO3溶液200 mL,该反应的离子方程式为___________________________。
(4)用100mL12.0 mol·L-1的浓盐酸与足量MnO2混合后,加热,反应产生的氯气物质的量远远少于0.30 mol,请你分析可能的原因为___________________________。