网址:http://m.1010jiajiao.com/timu3_id_389447[举报]
(12分)向一个体积可变的密闭容器中充入4 mol A、1 mol B,发生如下的反应:4A (g)+B(s) 3C(s)+4D(g)。在高温下达到平衡,测得混合气体中D的浓度为0.3 mol·L-1 。请填写下列空白:
(1)若容器体积为10 L,反应经2 min达平衡,则以A物质浓度变化表示的化学反应速率为 ,达平衡时A物质的转化率为 。
(2)若压缩容器增大压强,则逆反应的速率 ,容器中D的体积分数 。(填“增大”“减小”或“不变”)
(3)若相对分子质量M(B)>3M(C),温度升高时混合气体的平均相对分子质量减小,则正反应 。(填“吸热”或“放热”)
(4)在最初的容器中改充1.5 mol C、4.4 mol D,温度保持不变,要使反应达平衡时D的浓度为0.6mol·L-1,则容器的体积是 L。
查看习题详情和答案>>
(12分)向一个体积可变的密闭容器中充入4 mol A、1 mol B,发生如下的反应:4A (g)+B(s)  3C(s)
+4D(g)。在高温下达到平衡,测得混合气体中D的浓度为0.3 mol·L-1 。请填写下列空白:
3C(s)
+4D(g)。在高温下达到平衡,测得混合气体中D的浓度为0.3 mol·L-1 。请填写下列空白:
(1)若容器体积为10 L,反应经2 min达平衡,则以A物质浓度变化表示的化学反应速率为 ,达平衡时A物质的转化率为 。
(2)若压缩容器增大压强,则逆反应的速率 ,容器中D的体积分数 。(填“增大”“减小”或“不变”)
(3)若相对分子质量M(B)>3M(C),温度升高时混合气体的平均相对分子质量减小,则正反应 。(填“吸热”或“放热”)
(4)在最初的容器中改充1.5 mol C、4.4 mol D,温度保持不变,要使反应达平衡时D的浓度为0.6 mol·L-1,则容器的体积是 L。
查看习题详情和答案>>
 3C(s)+ 4D(g)。在高温下达到平衡,测得混合气体中D的浓度为0.3 mol/L。请填写下列空白:
3C(s)+ 4D(g)。在高温下达到平衡,测得混合气体中D的浓度为0.3 mol/L。请填写下列空白:(1)若容器体积为10 L,反应经2 min达到平衡,则以A 物质浓度变化表示的化学反应速率为_________,平衡时A物质的转化率为___________。
(2)若压缩容器增大压强,则逆反应的反应速率_________(填“增大”、“减小”或“不变”,下同),容器中D的体积分数____________。
(3)若相对分子质量M(B)>3M(C),温度升高时混合气体的平均相对分子质量减小,则正反应______ (填“吸热”或“放热”)。
(4)在最初的容器中改充1.5 mol C、4.4 mol D,温度保持不变,要使反应达平衡时D的浓度为0.6 mol/L,则容器的体积是__________L。
向一个体积可变的密闭容器中充入4 mol A、1 mol B,发生如下反应:4A(g)+B(s)![]() 3C(s)+4D(g).在高温下达到平衡,测得混合气体中D的浓度为0.3 mol·L-1.请填写下列空白:
3C(s)+4D(g).在高温下达到平衡,测得混合气体中D的浓度为0.3 mol·L-1.请填写下列空白:
(1)若容器体积为10 L,反应经2 min达平衡,则以A物质浓度变化表示的化学反应速率为________,达平衡时A物质的转化率为________.
(2)若压缩容器增大压强,则逆反应的速率________,容器中D的体积分数________(填“增大”“减小”或“不变”).
(3)若相对分子质量M(B)>3M(C),温度升高时混合气体的平均相对分子质量减小,则正反应________(填“吸热”或“放热”).
(4)在最初的容器中改充1.5 mol C、4.4 mol D,温度保持不变,要使反应达平衡时D的浓度为0.6 mol·L-1,则容器的体积是________L.
在一容积为4 L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下,发生如下反应:
N2(g)+3H2(g)![]() 2NH3(g ) △H<0 ,
2NH3(g ) △H<0 ,
反应中NH3的物质的量浓度变化情况如右图:
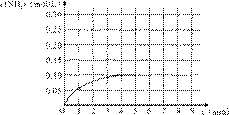
(1)根据上图,计算从反应开始到平衡时,平
均反应速率v(NH3)为______mol/(L·min)。
(2)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为___________。
a. 0.20 mol/L b. 0.12 mol/L c. 0.10 mol/L d. 0.08 mol/L
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡___________________移动(填“向逆反应方向”、“向正反应方向”或“不”)。
(4)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
(5)在三个相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图。下列说法正确的是 (填序号) 。
(A)图Ⅰ可能是不同压强对反应的影响,且P2>P1
(B)图Ⅱ可能是不同压强对反应的影响,且P1>P2
(C)图Ⅲ可能是不同温度对反应的影响,且T1>T2
(D)图Ⅱ可能是同温同压下,催化剂性能对反应的影响,且1>2
查看习题详情和答案>>