摘要:68.用一定浓度的NaOH标准溶液分别中和相同体积和相同pH值的两种酸溶液:一元强酸HA1.一元弱酸HA2.则中和HA1和HA2所需NaOH溶液的体积比是 A 50︰1 B 1︰1 C 1︰5 D 1︰50 [2001-2002湖北竞赛]
网址:http://m.1010jiajiao.com/timu3_id_38944[举报]
用一定浓度的NaOH标准溶液分别中和相同体积和相同pH值的两种酸溶液:![]() (一元弱酸,电离度1.0%)、
(一元弱酸,电离度1.0%)、![]() (一元强酸),则所需NaOH溶液体积比(
(一元强酸),则所需NaOH溶液体积比(![]() ∶
∶![]() )
)
[ ]
A.1∶1
B.1∶10
C.100∶1
D.1∶100
氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用.请你根据所学知识回答下列问题:
Ⅰ.把氯气通入紫色石蕊溶液中,可以观察到的现象是: ;氯气与水反应生成次氯酸(HClO)具有杀菌作用,常用于自来水消毒.请写出氯气与水反应的离子方程式
Ⅱ.某化学兴趣小组计划用氯气和氢氧化钠制取简易消毒液.
(1)其反应原理为:(用离子方程式表示) .
(2)某同学帮助水质检测站配制500mL0.5mol.L-1 NaOH 溶液以备使用.
①该同学应称取NaOH固体 g
②上述实验需要的仪器除天平、药匙、烧杯、玻璃棒外,还必须用到的仪器有 、 .
③该配制实验两次用到玻璃棒,其作用分别是 、 .
④配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不影响”)
a、没有洗涤烧杯和玻璃棒 ;
b、定容时俯视容量瓶瓶颈刻度线 .
⑤取上述配制的NaOH溶液 L才能与0.224L氯气(标准状况下)恰好完全反应.
(3)工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,用化学反应方程式可表示为 ,漂白粉的有效成分是 .
查看习题详情和答案>>
Ⅰ.把氯气通入紫色石蕊溶液中,可以观察到的现象是:
Ⅱ.某化学兴趣小组计划用氯气和氢氧化钠制取简易消毒液.
(1)其反应原理为:(用离子方程式表示)
(2)某同学帮助水质检测站配制500mL0.5mol.L-1 NaOH 溶液以备使用.
①该同学应称取NaOH固体
②上述实验需要的仪器除天平、药匙、烧杯、玻璃棒外,还必须用到的仪器有
③该配制实验两次用到玻璃棒,其作用分别是
④配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不影响”)
a、没有洗涤烧杯和玻璃棒
b、定容时俯视容量瓶瓶颈刻度线
⑤取上述配制的NaOH溶液
(3)工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,用化学反应方程式可表示为
氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用.请你根据所学知识回答下列问题:
Ⅰ.把氯气通入紫色石蕊溶液中,可以观察到的现象是:______;氯气与水反应生成次氯酸(HClO)具有杀菌作用,常用于自来水消毒.请写出氯气与水反应的离子方程式______
Ⅱ.某化学兴趣小组计划用氯气和氢氧化钠制取简易消毒液.
(1)其反应原理为:(用离子方程式表示)______.
(2)某同学帮助水质检测站配制500mL0.5mol.L-1 NaOH 溶液以备使用.
①该同学应称取NaOH固体______g
②上述实验需要的仪器除天平、药匙、烧杯、玻璃棒外,还必须用到的仪器有______、______.
③该配制实验两次用到玻璃棒,其作用分别是______、______.
④配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不影响”)
a、没有洗涤烧杯和玻璃棒______;
b、定容时俯视容量瓶瓶颈刻度线______.
⑤取上述配制的NaOH溶液______L才能与0.224L氯气(标准状况下)恰好完全反应.
(3)工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,用化学反应方程式可表示为______,漂白粉的有效成分是______.
查看习题详情和答案>>
氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用.请你根据所学知识回答下列问题:
Ⅰ.把氯气通入紫色石蕊溶液中,可以观察到的现象是:______;氯气与水反应生成次氯酸(HClO)具有杀菌作用,常用于自来水消毒.请写出氯气与水反应的离子方程式______
Ⅱ.某化学兴趣小组计划用氯气和氢氧化钠制取简易消毒液.
(1)其反应原理为:(用离子方程式表示)______.
(2)某同学帮助水质检测站配制500mL0.5mol.L-1NaOH溶液以备使用.
①该同学应称取NaOH固体______g
②上述实验需要的仪器除天平、药匙、烧杯、玻璃棒外,还必须用到的仪器有______、______.
③该配制实验两次用到玻璃棒,其作用分别是______、______.
④配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不影响”)
a、没有洗涤烧杯和玻璃棒______;
b、定容时俯视容量瓶瓶颈刻度线______.
⑤取上述配制的NaOH溶液______L才能与0.224L氯气(标准状况下)恰好完全反应.
(3)工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,用化学反应方程式可表示为______,漂白粉的有效成分是______.
查看习题详情和答案>>
Ⅰ.把氯气通入紫色石蕊溶液中,可以观察到的现象是:______;氯气与水反应生成次氯酸(HClO)具有杀菌作用,常用于自来水消毒.请写出氯气与水反应的离子方程式______
Ⅱ.某化学兴趣小组计划用氯气和氢氧化钠制取简易消毒液.
(1)其反应原理为:(用离子方程式表示)______.
(2)某同学帮助水质检测站配制500mL0.5mol.L-1NaOH溶液以备使用.
①该同学应称取NaOH固体______g
②上述实验需要的仪器除天平、药匙、烧杯、玻璃棒外,还必须用到的仪器有______、______.
③该配制实验两次用到玻璃棒,其作用分别是______、______.
④配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不影响”)
a、没有洗涤烧杯和玻璃棒______;
b、定容时俯视容量瓶瓶颈刻度线______.
⑤取上述配制的NaOH溶液______L才能与0.224L氯气(标准状况下)恰好完全反应.
(3)工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,用化学反应方程式可表示为______,漂白粉的有效成分是______.
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是
(A)酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
(B)滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
(C)酸式滴定管在滴定前有气泡,滴定后气泡消失
(D)读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示: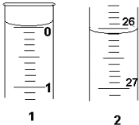 则起始读数为
则起始读数为
(4)某学生根据三次实验分别记录有关数据如表:
请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)=
查看习题详情和答案>>
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视
锥形瓶中溶液颜色变化
锥形瓶中溶液颜色变化
.直到因加入一滴盐酸后,溶液由黄色变为橙色,并半分钟内不复原
半分钟内不复原
为止.(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是
D
D
(A)酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
(B)滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
(C)酸式滴定管在滴定前有气泡,滴定后气泡消失
(D)读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:
 则起始读数为
则起始读数为0.00
0.00
mL,终点读数为26.10
26.10
mL;所用盐酸溶液的体积为26.10
26.10
mL.(4)某学生根据三次实验分别记录有关数据如表:
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
0.1044mol/L
0.1044mol/L
(保留小数点后4位).