摘要:19.现有浓度为0.1 mol·L-1的五种电解质溶液①Na2CO3 ②NaHCO3 ③NaAlO2 ④CH3COONa ⑤NaOH 已知:CO2+3H2O+2AlO2-===2Al(OH)3↓+CO32- (1)这五种溶液的pH由小到大的顺序是 ▲ (2)将五种溶液稀释相同的倍数时.其pH变化最大的是 ▲ (3)在上述五种溶液中分别加入AlCl3溶液.能产生大量无色无味气体的是 ▲ (4)将上述①.②.③.④四种溶液两两混合时.有一对溶液相互间能发生反应.写出该反应的离子方程式 ▲ .
网址:http://m.1010jiajiao.com/timu3_id_389135[举报]
现有浓度为0.1 mol·L-1的五种电解质溶液①Na2CO3 ②NaHCO3 ③NaAlO2 ④CH3COONa⑤NaOH
已知:CO2+3H2O+2![]()
![]() 2Al(OH)3↓+
2Al(OH)3↓+![]()
(1)这五种溶液的pH由小到大的顺序是______________(填编号)。
(2)将五种溶液稀释相同的倍数时,其pH变化最大的是______________(填编号)。
(3)在上述五种溶液中分别加入AlCl3溶液,能产生大量无色无味气体的是______(填编号)。
(4)将上述①②③④四种溶液两两混合时,有一对溶液相互间能发生反应,写出该反应的离子方程式:______________。
查看习题详情和答案>>现有浓度为0.1 mol·L-1的五种电解质溶液:
① Na2CO3 ② NaHCO3 ③ NaAlO2 ④ CH3COONa ⑤ NaOH
(1)这五种溶液的pH由小到大的顺序是______(填编号);
(2)将五种溶液稀释相同的倍数时,其pH变化最大的是______(填编号);
(3)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
① Na2CO3 ② NaHCO3 ③ NaAlO2 ④ CH3COONa ⑤ NaOH
(1)这五种溶液的pH由小到大的顺序是______(填编号);
(2)将五种溶液稀释相同的倍数时,其pH变化最大的是______(填编号);
(3)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
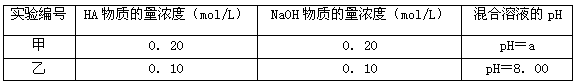
不考虑乙组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸_________________________;
乙组实验所得混合溶液中由水电离出的c (OH-)=____________mol/L。 求出该混合溶液中下列算式的值,要求写出推理、计算过程。
I.c (Na+)-c (A-): ________________________________________________________________________________________;
II.c (OH-)-c (HA): _________________________________________________________________________________________。
查看习题详情和答案>>
乙组实验所得混合溶液中由水电离出的c (OH-)=____________mol/L。 求出该混合溶液中下列算式的值,要求写出推理、计算过程。
I.c (Na+)-c (A-): ________________________________________________________________________________________;
II.c (OH-)-c (HA): _________________________________________________________________________________________。
(共8′)
现有浓度为0.1 mol·L-1的五种电解质溶液 ① Na2CO3、② NaHCO3、③ NaAlO2
④ CH3COONa、⑤NaOH。已知:CO2+3H2O+2AlO2-===2Al(OH)3↓+CO32-,试回答:
(1)这五种溶液的pH由大到小的顺序是
(用编号填写,下同);
(2)将五种溶液稀释相同的倍数时,其pH变化最大的是 ;
(3)在上述五种溶液中分别加入AlCl3溶液,能产生大量无色无味气体的是________;
(4)将上述①、②、③、④四种溶液两两混合时,有一对溶液相互间能发生反应,写出该反应的离子方程式 。
查看习题详情和答案>>